Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
KatalyseAls Katalyse (griechisch κατάλυσις, katálysis – die Auflösung, Abschaffung, Aufhebung) wird die Veränderung der Reaktionsgeschwindigkeit einer chemischen Reaktion durch Beteiligung eines Katalysators bezeichnet. Der Katalysator geht unverändert aus der Gesamtreaktion wieder hervor und kann somit mehrere Katalysezyklen durchlaufen, während der Substrat genannte Ausgangsstoff abgebaut und das Produkt aufgebaut wird. Der Begriff „Katalyse“ wurde 1835 von Jöns Jakob Berzelius in Analogie zu „Analyse“ gewählt.[1] Produkt-Highlight
Energetische Grundlagen der Katalyse
Katalysatoren erhöhen die Reaktionsgeschwindigkeit von chemischen Reaktionen um mehrere Größenordnungen. Es ist allerdings nicht möglich, Reaktionen durchzuführen, die thermodynamisch verboten sind in der Hinsicht, dass die Gesamtenergie der Produkte höher liegt als die der Ausgangsstoffe. Wie bei jeder spontan ablaufenden Reaktion muss die freie Reaktionsenthalpie (ΔG) negativ sein. Das chemische Gleichgewicht wird durch einen Katalysator nicht verändert, wohl aber die Geschwindigkeit, mit der es sich einstellt. Die katalytische Wirksamkeit beruht einzig auf der Fähigkeit, die Aktivierungsenergie KatalysatorEin Katalysator ist ein Stoff, der die Reaktionsgeschwindigkeit einer chemischen Reaktion verändert, ohne dabei verbraucht zu werden. Der Katalysator beschleunigt (oder verlangsamt) eine Reaktion bzw. setzt die notwendige Aktivierungsenergie herab (oder herauf), so dass eine Reaktion z. B. bei niedrigeren (oder höheren) Temperaturen stattfindet. In der Industrie finden hauptsächlich beschleunigende Katalysatoren Verwendung. Viele Reaktionen sind überhaupt erst durch einen Katalysator möglich, weil ohne Katalysator die Reaktion extrem langsam ablaufen würde (z. B. in einigen Millionen Jahren) oder weil bei der zur Reaktion ohne Katalysator notwendigen Temperatur das thermodynamische Gleichgewicht auf der Seite der Ausgangsstoffe liegt. Allgemeines BeispielEine einfache chemische Reaktion A + B → AB kann z. B. folgendermaßen durch einen Katalysator K beeinflusst werden. A + K → AK AK + B → AB + K Hiermit ist auch erklärt, dass entgegen der Vermutung aus der Frühgeschichte der Chemie nicht nur die Anwesenheit eines Katalysators die Reaktion beeinflusst, sondern der Katalysator tatsächlich an der Reaktion beteiligt ist, auch wenn er hinterher unverändert vorliegt. EinteilungEs wird grundlegend zwischen heterogener Katalyse und homogener Katalyse unterschieden. Eine Sonderform stellt die Phasentransferkatalyse dar. Teilweise wird auch die Biokatalyse als Sonderform betrachtet. Als heterogene Katalyse werden die Reaktionen bezeichnet, bei denen sich der Katalysator und die Ausgangsstoffe der Reaktion in unterschiedlichen Phasen befinden (z. B. wenn in Erdölraffinerien das aufgeheizte Erdöl im Gaszustand mit festen Katalysatoren, sog. Kontakten, reagiert oder wenn im Fahrzeugkatalysator die gasförmigen Verbrennungsprodukte an einem Feststoff zu weniger giftigen Abgasen reagieren). Bei der homogenen Katalyse befinden sich sowohl die Ausgangsstoffe als auch der Katalysator in der gleichen Phase. Vielfach handelt es sich dabei um Reaktionen mit flüssigen Ausgangsstoffen, bei denen z. B. eine katalytisch wirkende Säure als Flüssigkeit hinzugegeben wird. Auch die Olefinmetathese wird durch homogene Übergangsmetallkatalysatoren katalysiert. Mechanismen in der heterogenen KatalyseBei monomolekularen Reaktionen zerfällt z. B. einfach das Edukt an der Katalysatoroberfläche. Bei bimolekularen Reaktionen sind drei Mechanismen denkbar: 1. Langmuir-Hinshelwood-MechanismusBeim Langmuir-Hinshelwood-Mechanismus werden zunächst beide Edukte A und B aus der Gasphase auf der Katalysatoroberfläche adsorbiert: Ag → Aads Bg → Bads Anschließend reagieren die adsorbierten Edukte auf der Katalysatoroberfläche zu Produkt C ab: Aads + Bads → Cads Im letzten Schritt desorbiert Produkt C: Cads → Cg 2. Eley-Rideal-MechanismusBeim Eley-Rideal-Mechanismus adsorbiert zunächst Edukt A auf der Katalysatoroberfläche: Ag → Aads Anschließend reagiert das adsorbierten Edukt mit einem weiteren Edukt B aus der Gasphase zum Produkt C: Aads + Bg → Cads Im letzten Schritt desorbiert Produkt C: Cads → Cg 3. Mars-van-Krevelen-MechanismusEdukt A wird zunächst aus der Gasphase auf der Katalysatoroberfläche adsorbiert: Ag → Aads Anschließend folgt die Oxidation von Edukt A mit vorhandenem Gittersauerstoff: Aads + Osurf → AOads Produkt AO desorbiert und es entsteht eine Sauerstoffleerstelle im Kristallgitter: AOads → AOg + Leerstelle Nach der Desorption werden durch Adsorption von Sauerstoff die Leerstellen wieder aufgefüllt: O2,g → 2 Oads → 2 Osurf BiokatalyseStoffwechselvorgänge in Lebewesen werden durch Enzyme katalysiert. Diese Reaktionen zeichnen sich allgemein durch äußerst hohe Effizienz und Selektivität aus und laufen bei milden Temperaturen und in wässrigem Milieu ab. Reaktive Spezies, die mit Wasser reagieren würden, werden durch hydrophobe „Taschen“ abgeschirmt. Viele Biokatalysatoren sind Proteine oder enthalten Proteinbestandteile. PhasentransferkatalyseVermittelt ein Katalysator den Kontakt zweier Reaktanden, die in unterschiedlichen Phasen (meist wässrige und organische Phase) vorliegen, so spricht man von Phasentransferkatalyse. Der Katalysator einer solchen Reaktion ermöglicht den Durchtritt der Reaktanden durch die Phasengrenze. Beispielsweise ermöglichen Kronenether die Lösung von Alkalimetallionen in organischen Lösungsmitteln; quartäre Ammoniumverbindungen mit lipophilen Alkylresten verbessern die Löslichkeit unpolarer Moleküle in Wasser. Einige typische Beispiele für Katalyse-Vorgänge
Einzelnachweise
LiteraturÄltere Literatur
Aktuelle Literatur
Siehe auch |
|
| Dieser Artikel basiert auf dem Artikel Katalyse aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





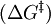 einer chemischen Reaktion zu senken. Die Aktivierungsenergie ist der Energiebetrag, der zunächst überwunden werden muss, um die Reaktion in Gang zu setzen. Während der Reaktion wird das
einer chemischen Reaktion zu senken. Die Aktivierungsenergie ist der Energiebetrag, der zunächst überwunden werden muss, um die Reaktion in Gang zu setzen. Während der Reaktion wird das 

