Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
KolloideAls Kolloide (griechisch kólla = „Leim“) werden meist Teilchen oder Tröpfchen in einer Suspension bezeichnet, die klein genug sind (typischerweise 0,1–10 Mikrometer), um durch Stöße mit den Flüssigkeitsmolekülen Brownsche Bewegung zu zeigen. kolloidale Suspensionen haben große Bedeutung in der Nahrungsmittel- und Kosmetikindustrie, jedoch auch in der Grundlagenforschung, insbesondere in der statistischen Physik. Produkt-Highlight
BegriffDer britische Physiker Thomas Graham führte 1861 den englischen Begriff „colloid“ ein, den er von dem griechischen Wort für Leim ableitete. Er benutzte ihn, um Stoffe aufgrund ihres Diffusionsverhaltens in „kristalloide“ und „kolloidale“ Substanzen zu unterteilen. Es stellte sich später heraus, dass Grahams Kriterien nicht sinnvoll waren. Was er als kolloidal bezeichnete war nicht eine chemische Eigenschaft, sondern ein Zustand der feinen physikalischen Unterteilung bestimmter Proben. Seit Beginn des zwanzigsten Jahrhunderts wird der Begriff im Sinne der modernen Definition verwendet.[1] Allgemeinere Definition und BeispieleWährend bei Kolloiden meist an Emulsionen oder Suspensionen von Tröpfchen oder Teilchen in einer Flüssigkeit gedacht wird, so wird der Begriff des kolloidalen Systems oft für jede Art von Phase verwendet, die in einer anderen, kontinuierlichen Phase entsprechend fein dispergiert ist. Damit handelt es sich bei allen folgenden Beispielen um Kolloidsysteme:
BedeutungChemieDie Kolloidchemie, die die Eigenschaften kolloiddisperser Systeme untersucht, ist ein selbstständiges Gebiet innerhalb der physikalischen Chemie. PhysikKolloidsuspensionen sind wichtige Modellsysteme um Vorhersagen der statistischen Thermodynamik zu überprüfen oder atomare Festkörperprozesse zu simulieren.[2]
VerfahrenstechnikKolloiddisperse Systeme haben durch die feine Verteilung der einen Phase in die andere im Verhältnis zu ihrem Volumen eine enorm große Grenzfläche. Dies wird überall ausgenutzt, wo Grenzflächeneffekte wichtig sind, z. B. in der Trocknungstechnik oder bei der Reaktion zweier nichtmischbarer Flüssigkeiten. Wechselwirkungen von KolloidteilchenFolgende Wechselwirkungen können zwischen Kolloidteilchen auftreten:
Quellen
Literatur
|
|
| Dieser Artikel basiert auf dem Artikel Kolloide aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





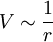 . Haben die Kolloide unterschiedliche Ladungen, so bilden sie ein ionisches Modellsystem (einige Teilchen ziehen sich gegenseitig an, andere stoßen sich ab). In der Flüssigkeit vorhandene Ionen (z. B. gelöstes Salz) können das elektrostatische Potential mehr oder weniger abschirmen.
. Haben die Kolloide unterschiedliche Ladungen, so bilden sie ein ionisches Modellsystem (einige Teilchen ziehen sich gegenseitig an, andere stoßen sich ab). In der Flüssigkeit vorhandene Ionen (z. B. gelöstes Salz) können das elektrostatische Potential mehr oder weniger abschirmen.
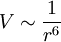 aus. Sie lassen sich minimieren, indem die
aus. Sie lassen sich minimieren, indem die 

