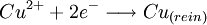Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
KupferraffinationKupferraffination bezeichnet ein technisches Verfahren zur Herstellung von Kupfer. Produkt-HighlightKupfer kommt in der Natur als gediegenes Metall vor, das vor allem in Nordamerika, Chile und Australien zu finden ist. Im gebundenen Zustand kennen wir es als Erz in Form von Sulfiden (z. B. Covellin und Buntkupferkies), Oxiden (z. B. Cuprit), Karbonaten (z. B. Malachit und Azurit), Chloriden und Arseniden. Besonders reiche Lager an Kupfererzen finden sich in den USA, in Kanada, Russland, Chile, im Kongogebiet und in Simbabwe. Die Kupfererze besitzen einen relativ geringen Kupfergehalt, daher müssen sie durch Flotation (Schwimmaufbereitung) angereichert werden. Dabei werden die zermahlenen Erze mit Wasser verrührt. Metallsulfide und Metalloxide stoßen Wasser ab, während die Gesteine der Gangart (Quarz, Silikate) leicht benetzt werden. Durch Zugabe eines Schaums werden die schweren Erzteilchen an die Wasseroberfläche transportiert und können abgeschöpft werden (Näheres siehe unter Titandioxid). Das gereinigte Erz wird in mehreren Schritten in Röstöfen zuerst zu Kupferoxid oxidiert, das dann mit Kupfersulfid (aus dem Erz) zu unreinem "Garkupfer" reduziert wird, welches einen Reinheitsgrad von etwa 98,5 % besitzt. Für eine ganze Reihe von Produktionsbereichen, z. B. für die Elektroindustrie reicht jedoch die Reinheit von Garkupfer nicht aus, so dass eine weitere Aufbereitung erforderlich wird. Bei der elektrolytischen Kupferraffination hängt man Elektrodenplatten aus Garkupfer als Anoden in eine angesäuerte Kupfersulfatlösung. Als Kathoden dienen entweder Bleche aus Reinkupfer, oder Edelstahlbleche (Mt. Isa-Verfahren). Die Elektrolyse wird in großen Elektrolysierwannen, in denen einige hundert Elektroden in Parallelschaltung zusammengeschaltet sind, bei Spannungen von 0,2 - 1 Volt, durchgeführt. Dabei laufen folgende Prozesse ab: An der Anode erfolgt eine Oxidation des Kupfers und aller unedleren Metalle, so dass die Kupferionen (Cu2+) und unedleren Metallionen (Zn2+) in Lösung gehen. Verunreinigungen aus edleren Metallen, die ein deutlich größeres Normalpotential (U0) als Kupfer besitzen, werden zwar nicht oxidiert, fallen aber, da sich die Garkupferelektrode auflöst, als sogenannter Anodenschlamm zu Boden. An der Kathode werden diejenigen Kationen der Lösung reduziert (Cu2+), die das größte Bestreben dazu haben, d. h., die das größte Normalpotential (U0) besitzen. Das reine Kupfer scheidet sich an der Kathode ab, während alle unedleren Metallionen wie Eisen-, Zink- und Bleiionen in Lösung bleiben. Reaktionsgleichungen: Vor- & NachteileVorteile des Verfahrens: Der Anodenschlamm bildet ein wertvolles Nebenprodukt. Aus ihm werden in den Kupferhütten durch weitere Aufarbeitung größere Mengen reines Silber, Gold und Platin gewonnen. Das sehr reine, metallische Kupfer ist sehr weich, aber sehr zäh, schmiedbar und dehnbar. Nachteile: Das Verfahren ist sehr kostspielig und energieaufwendig: Der Energiebedarf für die Herstellung von einer Tonne Reinkupfer beträgt etwa 250 kWh. Kategorien: Verfahrenstechnik | Metallurgie | Trennverfahren |
| Dieser Artikel basiert auf dem Artikel Kupferraffination aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |