Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
ManganometrieDie Manganometrie ist eine Methode der chemischen quantitativen Analyse, bei der die besonderen Eigenschaften des Kaliumpermanganats eine Redoxtitration ohne weiteren Indikator ermöglichen. Produkt-HighlightEigenschaftenDas Permanganation MnO4- ist zum einen ein starkes Oxidationsmittel, das selbst Chlorwasserstoffsäure zu Chlorgas oxidiert. Die Manganometrie eignet sich so zur Konzentrationsbestimmung einer Vielfalt von Stoffen, sofern sich diese oxidieren lassen. Zum anderen färbt gelöstes MnO4- (Oxidationsstufe +7) Wasser intensiv dunkelviolett, während eine reduzierte Form, das Mn2+-Ion (Oxidationsstufe +2), nur ganz schwach rosa gefärbt ist. Bei der manganometrischen Konzentrationsbestimmung handelt es sich also um eine Redoxtitration mit einer Kaliumpermanganatlösung als Maßlösung. Der Endpunkt der Titration lässt sich sehr gut erkennen: Sobald der zu untersuchende Stoff vollständig oxidiert ist und das zuletzt zugegebene MnO4- nicht mehr reduziert wird, färbt sich die Lösung dauerhaft deutlich sichtbar violett - selbst kleine Mengen reichen wegen der intensiven Farbe dafür aus. Durchführung einer TitrationAn dieser Stelle soll kurz und vereinfacht die Konzentrationsbestimmung einer vorliegenden Eisen(II)-Lösung besprochen werden. Die Konzentration einer Permanganatlösung verändert sich unter Lichteinfluss. Daher muss die Titrierlösung zeitnah mithilfe einer anderen Lösung bekannter Konzentration neu eingestellt werden (das heißt ihre Konzentration muss bestimmt werden). Dafür kann man zum Beispiel eine Natriumthiosulfatlösung oder eine Natriumoxalatlösung (Salz der Oxalsäure) nehmen. Die Reaktionsgleichung letzterer soll hier als das erste Beispiel für eine Redoxgleichung mit Kaliumpermanganat dienen. Die Anwesenheit von Schwefelsäure ist nötig, weil das Permanganat in einer nicht ausreichend sauren Umgebung zu Braunstein (Mangandioxid, MnO2) reduziert wird. Chlorwasserstoffsäure darf dabei nicht verwendet werden, da das Cl--Ion wie schon erwähnt oxidiert werden würde. Die Reaktionsgleichung lautet: Aus den erzielten Resultaten lässt sich stöchiometrisch die Konzentration der Titrierlösung berechnen (siehe letzter Abschnitt). Mit dieser Kaliumpermanganatlösung bekannter Konzentration kann nun eine Titration des zu untersuchenden Stoffes durchgeführt werden. Die gesuchte Konzentration lässt sich dann wie im nächsten Abschnitt gezeigt auf einfache Weise bestimmen. Ein Beispiel ist die Redoxreaktion mit einer Eisen(II)-Lösung: KonzentrationsberechnungFür die Konzentration c, Stoffmenge n und das Volumen V gilt allgemein
Man betrachte eine Lösung des Stoffes A mit der gesuchten Konzentration cA, bekanntem Volumen VA, Stoffmenge nA, und eine Kaliumpermanganatlösung mit cMnO4, VMnO4 und nMnO4. Es gilt: Das Verhältnis von nA zu nMnO4, das sich aus der Reaktionsgleichung ergibt, sei a. ( wodurch sich für die gesuchte Konzentration ergibt
Die Volumina und die Stoffmenge des MnO4- waren bekannt beziehungsweise Ergebnis des Experiments. |
| Dieser Artikel basiert auf dem Artikel Manganometrie aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





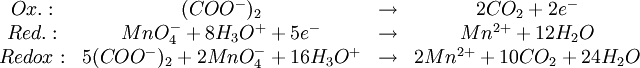
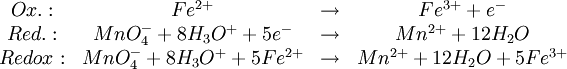
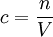 .
.
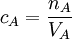
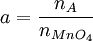 )
Für nMnO4 findet man dann
)
Für nMnO4 findet man dann
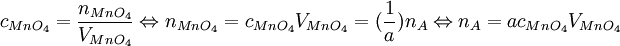
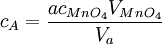 .
.


