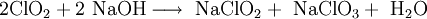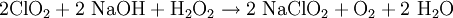Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Natriumchlorit
Natriumchlorit – nicht zu verwechseln mit dem Kochsalz Natriumchlorid – ist das Natriumsalz der Chlorigen Säure. Es kann zur Papierherstellung und zur Desinfektion von Wasser benutzt wird. Produkt-HighlightGewinnung und DarstellungNatriumchlorit kann aus der Reaktion von Chlordioxid mit Natronlauge erhalten werden. Hierzu wird die gasförmige Chlorverbindung in die Lauge eingeleitet. Als Produkt wird ein Gemisch aus Natriumchlorit und Natriumchlorat erhalten.
Reines Natrimchlorit kann durch zusätzliche Zugabe von Wasserstoffperoxid erhalten werden.[1]
VerwendungHauptanwendungsgebiet für Natriumchlorit ist die Erzeugung von Chlordioxid, ein Bleichmittel von Textilien und Papier. Weiterhin wird es zur Desinfektion von Wasser in Wasseraufbereitungsanlagen genutzt. Auch in Reinigungsmitteln von Kontaktlinsen ist es zu finden. Quelle
Kategorien: Gesundheitsschädlicher Stoff | Natriumverbindung | Chlorit |
||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Natriumchlorit aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||