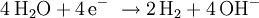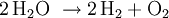Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Nickel-Cadmium-AkkumulatorEin Nickel-Cadmium-Akkumulator (NiCd-Akku) ist ein wiederaufladbarer Akkumulator (so genannte Sekundärzelle). Von der grundsätzlichen Bauart ist zwischen offenen und gasdichten Zellen zu unterscheiden. Gasdichte Zellen sind häufig baugleich zu handelsüblichen Batterien und können daher als Ersatz für diese sogenannten Primärzellen verwendet werden, offene Zellen werden für stationäre Anwendungen verwendet. Produkt-Highlight
GeschichteDer Nickel-Cadmium-Akkumulator wurde 1899 von dem Schweden Waldemar Jungner entwickelt. Der NiCd-Akkumulator gehört zu den alkalischen Batteriesystemen, an denen auch Thomas Alva Edison zu der Zeit parallel gearbeitet hat. Ein wesentlicher Unterschied zu dem bis dahin bekannten Bleiakkumulator ist, dass das Elektrolyt während der Ladung und Entladung unverändert bleibt. 1910 begann die industrielle Fertigung des NiCd-Akkumulators in Schweden. Diese ersten NiCd-Akkumulatoren hatten sogenannte Taschenelektroden, die auch heute noch üblich sind. Ungefähr 1930 wurden in Deutschland sogenannte Sinterelektroden entwickelt. Das Prinzip der gasdichten Zellen wurde 1933 von Dassler veröffentlicht. Serienreife gasdichte Zellen waren in den 50er Jahren verfügbar. Bis in die 90er Jahre hat sich der NiCd-Akkumulator zu der meistgebräuchlichen wiederaufladbaren Batterie im Endverbraucherbereich entwickelt. Zukünftig werden Nickel-Metallhydrid-Akkus (NiMH) und Lithium-Systeme mehr Bedeutung bekommen, da sie höhere Energiedichten aufweisen und keine umweltschädlichen Schwermetalle wie Cadmium enthalten. EU-weites VerbotIm Dezember 2004 hat der EU-Ministerrat eine Richtlinie verabschiedet, deren Ziel es ist, die technische Nutzung von Cadmium zu reduzieren. Vorbehaltlich der Zustimmung des EU-Parlaments sollen die Mitgliedsstaaten innerhalb von zwei Jahren durch nationale Gesetze zunächst Nickel-Cadmium-Akkus verbieten. Auf Wunsch einiger Mitgliedsstaaten – darunter auch Deutschland – sollen jedoch, unter anderem schnurlose Elektrowerkzeuge, so genannte Power Tools, von dem Verbot zunächst ausgenommen werden, weil „für Power Tools nicht sichergestellt ist, dass gleichwertiger Ersatz aktuell verfügbar ist“. Vier Jahre nach Inkrafttreten der Richtlinie soll diese Ausnahme jedoch überprüft werden, um das Cadmium-Verbot dann möglicherweise auszudehnen. Siehe auch RoHS. Alle Mitgliedsstaaten der EU wurden verpflichtet, diese Richtlinie in nationales Recht umzusetzen. 2006 hat das Europäische Parlament eine veränderte Version der Richtlinie angenommen, die Batterien und Akkumulatoren mit mehr als 0,002 Gewichtsprozent Cadmium verbietet.[1] EigenschaftenNiCd-Akkumulatoren haben eine nominale Spannung von 1,2 Volt, die somit 20 % unter den 1,5 Volt normaler Batterien liegt. Dies stellt jedoch kein Problem dar, da die meisten Geräte auf niedrige Spannungen von 0,9–1,0 Volt entladener Batterien ausgelegt sind. Durch den geringen Innenwiderstand von NiCd-Akkumulatoren können diese hohe Ströme liefern. NiCd-Akkus werden (auch deshalb) vor allem im Modellbau und bei anderen Hochstromanwendungen genutzt. NiCd-Akkus müssen bei einer Restspannung (Entladeschlussspannung) von 0,85 - 0,9V wieder aufgeladen werden, eine weitergehende Entladung führt zu Tiefentladung, die in ihren Auswirkungen mit dem (bei mit modernen Ladegeräten aufgeladenen, handelsüblichen NiCd-Akkus kaum vorhandenen) Memory-Effekt verwechselt wird. Eine bei anderen Technologien selten anzutreffende Eigenschaft ist das hervorragende Tieftemperaturverhalten von NiCd-Akkumulatoren. Selbst bei -40 °C besitzt ein Akku mit Faserstrukturplatten-Technik noch über 50 % seiner nominellen Kapazität bei Raumtemperatur. AufbauDie Elektroden des NiCd-Akkumulators bestehen in geladenem Zustand aus Platten, die am Minuspol mit fein verteiltem Cadmium und am Pluspol mit Nickel(III)-oxidhydroxid beladen sind. Als Elektrolyt wird 20%ige Kaliumhydroxid-Lösung verwendet. Diese Kombination liefert eine Spannung von 1,3 V. Bei Überladung des Akkumulators wird an der negativen Elektrode Wasserstoff und an der positiven Elektrode Sauerstoff produziert; man sagt der Akku „gast“. In geschlossenen, also gasdichten Zellen muss dies wegen der Explosionsgefahr unbedingt verhindert werden. Aus diesem Grund wird die negative Cadmiumelektrode überdimensioniert und dient als negative Entladereserve. Die positive Nickelelektrode enthält etwas Cadmiumhydroxid als „antipolare Masse“. Bei Überladung mit geringeren Laderaten (ca. 0,1 C), stellt sich so ein Gleichgewicht zwischen Sauerstofffreisetzung und -verbrauch ein, es wird kein Wasserstoff entwickelt. In gasdichten Faserstruktur-NiCd-Zellen wird der entstehende Sauerstoff an einer katalytisch wirksamen Oberfläche der Faserstruktur-Rekombinationselektrode so schnell rekombiniert, dass im Betrieb sogar ein leichter Unterdruck entsteht. AufladungSiehe Ladeverfahren. ElektrochemieNiCd-Akkumulatoren enthalten im geladenen Zustand:
Entladevorgang: An der Anode/negativen Elektrode wird Cadmium zum Cadmiumhydroxid (Cd(OH)₂) oxidiert. Die freiwerdenden Elektronen fließen dann über den Verbraucher zur Kathode/positiven Elektrode. Dort wird das Nickel(III)-oxidhydroxid NiOOH zu Nickel(II)hydroxid Ni(OH)₂ reduziert. Reaktionen:
Ladevorgang: die Reaktionen laufen in umgekehrter Richtung ab, die Cadmium-Elektrode ist dann ebenfalls Minuspol, aber Kathode, da hier reduziert wird, die Nickelelektrode ist entsprechend Pluspol/Anode, an dem eine Oxidation abläuft. Überladen: Gegen Ende des Ladezyklus steigt die Zellspannung an, ab etwa 1,55 bis 1,6 V wird die Zersetzungsspannung des Wassers unter den Bedingungen der Zelle überschritten, es kommt zum Gasen:
In gasdichten NiCd-Akkus wird ein Überschuss von Cadmium(II)-hydroxid verwendet. Am Pluspol entsteht beim Überladen Sauerstoff, während am Minuspol noch Cd2+ reduziert wird. Der Sauerstoff reagiert dann mit Cadmium weiter zu Cadmium(II)-hydroxid und wird so gleich wieder verbraucht. ProblemeNiCd-Akkus enthalten das giftige Schwermetall Cadmium und müssen daher über besondere Rücknahmesysteme gesondert entsorgt werden (siehe Abschnitt Entsorgung). Beim Überladen von NiCd-Akkumulatoren können diese beschädigt werden:
Auch Falschladung (Verpolen) beschädigt eine Zelle durch Ausgasen an der Anode. Dadurch entsteht auch hochentzündlicher Wasserstoff. Die Falschpolung einer Zelle innerhalb eines Akkupacks tritt bereits bei Tiefentladung auf. Die Zellen sind in Reihe geschaltet. Wenn die schwächste Zelle entladen ist, liegt an ihrer negativen Elektrode der Pluspol, an der positiven Elektrode der Minuspol der Nachbarzellen.
EntsorgungSiehe Hauptartikel: Batterierecycling Da NiCd-Akkus das giftige Schwermetall Cadmium enthalten, dürfen sie nicht über den Hausmüll entsorgt werden. Es gibt für sie besondere Rücknahmesysteme, in Deutschland etwa betrieben durch die Stiftung Gemeinsames Rücknahmesystem Batterien. NiCd-Akkus lassen sich bei ordnungsgemäßer Entsorgung gut wiederverwerten. Das Cadmium kann durch Destillation zurückgewonnen werden, da es einen wesentlich niedrigen Siedepunkt als die anderen Bestandteile des Akkus (in der Regel Nickel und Stahl) hat[2]. AnwendungOffene Zellen
Gasdichte Zellen
Siehe auchLiteratur
Referenzen |
|||||||||||||
| Dieser Artikel basiert auf dem Artikel Nickel-Cadmium-Akkumulator aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





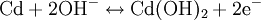
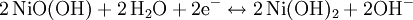
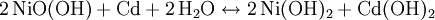
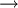 : Entladung
: Entladung
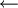 : Ladung
: Ladung