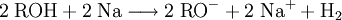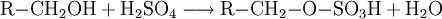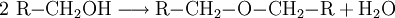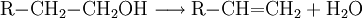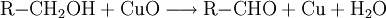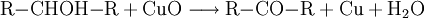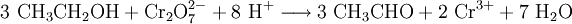Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
AlkoholeAls Alkohole (aus dem Arabischen al-kuhūl الكحول, oder al-ghawl الغول) bezeichnet die Chemie Verbindungen, die eine oder mehrere funktionelle Hydroxylgruppe(n) (-O-H) besitzen. Die Hydroxylgruppe muss an ein sp3-hybridisiertes Kohlenstoffatom (C-Atom mit 4 Sigmabindungen, also 4 Einfachbindungen) binden und es darf keinen weiteren höherwertigen Substituenten in der Verbindung geben. Alkohole, die sich von den Alkanen ableiten, werden nach IUPAC als Alkanole bezeichnet. Produkt-Highlight
NomenklaturDer Name einfacher Alkohole ergibt sich als Zusammensetzung aus dem Namen des ursprünglichen Alkans, plus die Endung "-ol". Zusätzlich wird die Position der OH-Gruppe durch eine vorangestellte Ziffer verdeutlicht, z. B. Propan-2-ol Nach der Zahl der vorhandenen OH-Gruppen bezeichnet man Alkohole mit einer OH-Gruppe auch als einwertig, Alkohole mit zwei oder drei OH-Gruppen als zwei- bzw. dreiwertig (Diole/Triole), und Alkohole mit vier oder mehr OH-Gruppen als mehrwertig oder allgemein als Polyalkohole (Polyole). Zusätzlich unterscheidet man Alkohole nach der Zahl der Kohlenstoffnachbarn des Kohlenstoffatoms, an welchem sich die OH-Gruppe befindet. Bei primären Alkoholen hat das C-Atom, das die OH-Gruppe trägt, eine Bindung zu einem weiteren C-Atom, bei sekundären zwei und bei tertiären drei. Physikalische EigenschaftenHohe SiedepunkteSauerstoff ist elektronegativer als Wasserstoff und Kohlenstoff, d. h. er zieht Elektronen stärker an als diese. Das führt zu einer unsymmetrischen Verteilung der Elektronen entlang der C-O-H-Bindung, man spricht von einer polaren Bindung, es bildet sich ein molekularer Dipol aus. Diese Dipole können untereinander Wasserstoffbrückenbindungen ausbilden, die die Anziehung der einzelnen Moleküle untereinander drastisch verstärken. Dies führt für Alkohole zu relativ hohen Siedepunkten gegenüber ihren unpolaren Homologen vergleichbarer molarer Masse (z. B. Alkane). So hat beispielsweise das unpolare Methan (CH4) einen Siedepunkt von -162 °C, während Methanol (CH3OH) diesen erst bei 65 °C erreicht. Zusammenfassend:
HydrophilieDie OH-Gruppe ist ebenfalls in der Lage, Wasserstoffbrückenbindungen mit Wasser einzugehen. Sie erhöht damit die Hydrophilie, die Wasserlöslichkeit, der Verbindung. Organische Alkylreste selbst sind nicht wasserlöslich, also hydrophob. Die Wasserlöslichkeit sinkt daher mit der Größe des organischen Anteils und steigt mit der Zahl der Hydroxydgruppen. Zusammenfassend:
AziditätDer pKs-Wert (Säurestärke) von Alkanolen liegt bei etwa 15. Sie reagieren somit in wässriger Lösung näherungsweise neutral. Es ist möglich, sie mit einer starken Base zu deprotonieren. Die deprotonierte Form eines Alkohols heißt Alkoholat. Ebenso ist es möglich, sie in gewissem Umfang mit starken Säuren zu protonieren: Industriell werden Alkoholate durch Umsetzung der entsprechenden Alkohole mit elementarem Natrium hergestellt: Spektroskopie von AlkoholenIm IR-Spektrum von Alkoholen ist deutlich die breite Bande der O-H-Valenzschwingung im Bereich von 3200–3650 cm−1 zu erkennen. Die Breite des Peaks wird durch Wasserstoffbrückenbindungen mit Wassermolekülen verursacht und ist in Spektren von wasserfreien Alkoholen in einem engeren Bereich von 3620–3650 cm−1 zu finden. Reaktionen der AlkoholeReaktion mit konz. SchwefelsäureUnterhalb von 140 °C bildet sich der Ester der Schwefelsäure. Bei ca. 140 °C findet die Kondensationsreaktion zu einem Ether statt. Oberhalb von 170 °C werden primäre Alkohole zu Alkenen dehydratisiert. (Eliminierung) VeresterungMit Carbonsäuren reagieren Alkohole unter Wasserabgabe zu Estern, diese Reaktion wird auch Veresterung genannt. Diese Reaktion wird durch Säuren katalysiert. OxidationPrimäre Alkohole lassen sich zu Aldehyden, sekundäre Alkohole zu Ketonen oxidieren. Tertiäre Alkohole lassen sich nicht weiter oxidieren, es sei denn unter Zerstörung des Kohlenstoffgerüsts. Oxidation eines primären Alkohols zu einem Aldehyd (Alkanal): Oxidation eines sekundären Alkohols zu einem Keton: AcetalbildungMit Aldehyden reagieren Alkohole in Gegenwart saurer Katalysatoren zu Halbacetalen bzw. Acetalen. Nachweis von AlkoholenWenn man zu einer flüssigen Alkoholprobe Natrium hinzufügt, so entsteht Wasserstoff, welches man mit der Knallgasprobe nachweisen kann. Diese Methode gilt zwar als Alkoholnachweis, ist jedoch nicht eindeutig, da alle ausreichend protonenaktiven Substanzen, z. B. Carbonsäuren, anorganische Säuren oder Wasser, die gleiche Reaktion eingehen. Der Umsatz von Alkoholen mit Dichromaten in schwefelsaurer Lösung ist geeignet, um Alkohole quantitativ nachzuweisen und wurde früher in den Alcotest-Röhrchen eingesetzt: Das Nachweisprinzip beruht auf dem Farbumschlag von gelb-orange (saure Dichromatlösung) nach grün (Chrom(III)-Ionen) und kann spektralphotometrisch gemessen werden. Eine weitere Möglichkeit besteht in der Umsetzung mit Cer(IV)-ammoniumnitrat. Hierbei wird eine konzentrierte Lösung von Cer(IV)-ammoniumnitrat mit einer verdünnten Lösung der unbekannten Substanz versetzt. Enthält die unbekannte Substanz Alkohol-Gruppen, färbt sich das Gemisch rot (manchmal auch grün). Enthält die Substanz Phenole, fällt ein brauner Niederschlag aus. Der Grund für diese Farbreaktion ist eine Komplexbildung, genauer gesagt eine Ligandensubstitution, bei der ein Alkohol/Phenol mit dem Sauerstoffatom am Cer(IV) koordiniert. Durch die Veränderung der Ligandensphäre verändert sich die Farbe des Cer(IV) von hellgelb zu rot/grün/braun. Leicht oxidierbare Alkohole/Phenole können einen negativen Nachweis ergeben, indem sie das Cer(IV) zu Cer(III) reduzieren. Der Nachweis des Substitutionsgrades eines Alkohols, also ob es sich dabei um einen primären, sekundären oder tertiären Alkohol handelt, erfolgt über nucleophile Substitution der OH-Gruppe gegen Chlorid durch die Lucas-Probe. Die Substitution hat zur Folge, dass sich die entstehende Substanz nicht mehr in Wasser löst und damit eine eigene Phase ausbildet. Dabei ist die Geschwindigkeit dieser Phasenbildung entscheidend:
Voraussetzung für diesen Test ist, dass sich der ursprüngliche Alkohol im Wasser löst. Auch darf keine andere unter den Reaktionsbedingungen substituierbare Gruppe vorliegen. Die eindeutige Identifizierung eines unbekannten Alkoholes erfolgt entweder spektroskopisch oder durch Synthese eines charakteristischen Derivates, das einen Schmelzpunkt hat, der von den Schmelzpunkten gleicher Derivate ähnlicher Alkohole gut zu unterscheiden ist. Meistens wird ein Carbonsäureester mit beispielsweise Benzoesäure hergestellt. Liste wichtiger Alkohole mit Siede- und Schmelzpunkten
Bei einzelnen Werten kann es in der Literatur zu Abweichungen kommen. (Siehe Diskussionsseite) QuellenKategorien: Alkohol | Stoffgruppe | Biomasse |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Alkohole aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||