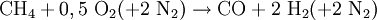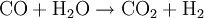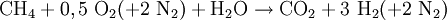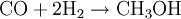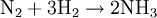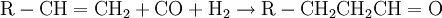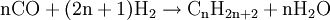Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
SynthesegasSynthesegase sind alle wasserstoffhaltigen Gasgemische, die in einer Synthesereaktion zum Einsatz kommen sollen. Produkt-Highlight
HerstellungDie Herstellung von Synthesegas kann prinzipiell aus festen, flüssigen und gasförmigen Edukten (Ausgangsstoffen) erfolgen. Synthesegas aus festen EduktenBei der Herstellung von Synthesegas aus festen Edukten ist vor allem die Kohlevergasung zu nennen. Kohle wird hierbei in einer Mischung aus partieller (teilweiser) Oxidation und Vergasung mit Wasserdampf zu einem Gemisch aus CO und Wasserstoff umgesetzt. Durch das Boudouard-Gleichgewicht steht CO noch mit C und CO2 im Gleichgewicht:
Die Umsetzung mit Sauerstoff liefert dabei durch die exotherme Reaktion die notwendige Energie zur Erzielung der hohen Reaktionstemperatur für die endotherme Vergasungsreaktion von Kohle mit Wasserdampf. Durch geschickte Wahl der Einsatzstoffe kann die Zusammensetzung des Synthesegases gesteuert werden (je nach gewünschtem Kohlenmonoxid- und Wasserstoffgehalt). Da in Kohle neben Kohlenstoff noch weitere Elemente enthalten sind, beispielsweise Schwefelverbindungen, muss das erhaltene Synthesegas nach dem Reaktor noch aufwändig gereinigt und aufbereitet werden. Hierbei müssen vor allem Wasser, CO2, Ruß und Schwefelverbindungen entfernt werden. Neben Kohle ist prinzipiell auch der Einsatz anderer Feststoffe wie z.B. Biomasse (Holz, Stroh) denkbar, jedoch ist hierbei auch eine Vorbehandlung der Einsatzstoffe und eine Nachbehandlung bzw. Reinigung des Synthesegases notwendig. Synthesegas aus flüssigen EduktenAls flüssige Edukte für Synthesegas können unterschiedliche Rohöldestillate eingesetzt werden, sowohl leichtsiedende als auch hochsiedende Fraktionen. Leichtsiedende Destillate können nach Entschwefelung durch Umsetzung mit Wasserdampf nach dem Dampfreformierung-Verfahren umgesetzt werden. Das Steam-Reforming-Verfahren ist eine endotherme Reaktion, welche an einem heterogenen Katalysator durchgeführt wird (Reaktion am Beispiel Pentan):
Beim Einsatz von hochsiedenden Ölfraktionen wird die partielle Oxidation durchgeführt, welche ohne Katalysator auskommt (Reaktion am Beispiel Pentan):
Synthesegas aus gasförmigen EduktenDas wichtigste gasförmige Edukt zur Synthesegaserzeugung ist Erdgas. Das Erdgas wird hierbei mit Wasserdampf nach dem Dampfreformierungs-Verfahren umgesetzt:
Erdgas liefert im Vergleich mit den anderen Edukten den höchsten Anteil an Wasserstoff im Verhältnis zu Kohlenmonoxid.
Synthesegas für die Ammoniak-Synthese stellt man auch durch partielle Oxidation her, wobei hier Luft anstelle von reinem Sauerstoff verwendet wird. Das anfallende Kohlenmonoxid wird in einer zweiten Reaktionsstufe mit Wasserdampf zu CO2 und weiterem Wasserstoff konvertiert (umgesetzt):
Summe: Nach Abtrennung von CO2 wird dann eine Mischung aus N2 und H2 erhalten, welche anschließend noch auf das gewünschte N2/H2-Molverhältnis eingestellt werden muss. SynthesegasreinigungAn alle genannten Herstellungsverfahren schließen sich nach dem Reaktor mehr oder weniger aufwändige und komplexe Reinigungs- und Aufbereitungsverfahren an. Im wesentlichen sind dies:
VerwendungAm häufigsten finden Synthesegase Verwendungen:
Kategorien: Stoffgemisch | Gas |
|
| Dieser Artikel basiert auf dem Artikel Synthesegas aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |




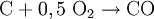 : ΔH = -110,5 kJ/mol
: ΔH = -110,5 kJ/mol 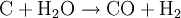 : ΔH = +131,3 kJ/mol
: ΔH = +131,3 kJ/mol 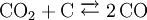 : ΔH = +172,4 kJ/mol
: ΔH = +172,4 kJ/mol 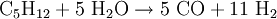 : ΔH = +802,9 kJ/mol
: ΔH = +802,9 kJ/mol 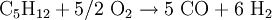 : ΔH = -406,3 kJ/mol
: ΔH = -406,3 kJ/mol 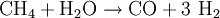 : ΔH = + 206,2 kJ/mol
: ΔH = + 206,2 kJ/mol 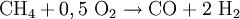 : ΔH = -35,7 kJ/mol
: ΔH = -35,7 kJ/mol