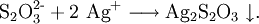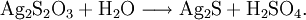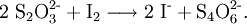Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
ThiosulfateThiosulfate sind Derivate der im freien Zustand unbeständigen Thioschwefelsäure H2S2O3. Ihre Salze enthalten das Thiosulfat-Anion S2O32-. Produkt-HighlightWässrige Lösungen von Thiosulfaten sind im basischen stabil. In Gegenwart von Säuren zerfallen sie aufgrund der Unbeständigkeit der freien Thioschwefelsäure in einer Redoxreaktion langsam zu Schwefel, Schwefeldioxid und Wasser:
Das in Chemie und Technik wichtigste Thiosulfat ist das Natriumsalz und Ammoniumsalz, auch Fixiersalz genannt. Es wird in der Fotografie zum Fixieren der belichteten Materialien (Filme, Fotopapier, Farb- und Schwarzweißmaterial) in der Dunkelkammer eingesetzt, da es das unbelichtete und damit unentwickelte Silberbromid als löslichen Dithiosulfatoargentatkomplex auflöst. (Bei Farbmaterial wird auch das reduzierte metallische Silber durch Bleichen entfernt, so dass die Emulsion nach der Verarbeitung silberfrei ist):
Mit Eisen(II)-ionen tritt Komplexbildung ein. Diese Reaktion ist gut geeignet, um mit Hilfe von Stoppuhr und Anblick die Abhängigkeit der Reaktionsgeschwindigkeit von der Temperatur und der (Stoffmengen-)Konzentration der Reaktionspartner zu demonstrieren. Mit Silberionen als Oxidationsmittel bildet sich bei Überschuss des Oxidationsmittels Silber(I)-sulfid und Schwefelsäure - eine Nachweisreaktion (Abendrotreaktion bzw. Sonnenuntergangsreaktion). Dabei entsteht zunächst ein weißer Niederschlag, der sich langsam von gelb über orange und braun bis hin zu schwarz, der Farbe des Silbersulfids, verfärbt. Die Reaktion erfolgt also in zwei Schritten: einer Fällungsreaktion mit sich anschließender Redoxreaktion. Im ersten Schritt wird das Thiosulfat durch Silberionen gefällt, und es entsteht ein weißer Niederschlag aus Silberthiosulfat:
Im zweiten Schritt zerfällt das Thiosulfat (Oxidationszahlen -1 und +5) langsam in Verbindungen mit beständigerer Oxidationszahl: Sulfid (-2) und Sulfat (+6):
Wird hingegen Thiosulfat im Überschuss zugegeben, so reagieren die Silberionen sofort zum oben genannten Dithiosulfatoargentatkomplex. Thiosulfat kann auch als Reduktionsmittel für Halogene verwendet werden. Da die entstehenden Halogenidionen weniger umweltgefährdend sind, ist dies eine Möglichkeit, Halogene zu entsorgen. Bei der ablaufenden Reaktion mit Thiosulfat werden die Lösungen von beispielsweise Iod oder Brom entfärbt, wobei Tetrathionat-Ionen und Halogenidionen entstehen:
Diese Reaktion findet bei der Iodometrie, ein Bestimmungsverfahren in der Analytischen Chemie, Anwendung. |
| Dieser Artikel basiert auf dem Artikel Thiosulfate aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





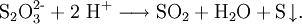
![\mathrm{2 \ Na_2S_2O_3 + AgBr \longrightarrow Na_3[Ag(S_2O_3)_2] + NaBr}.](images/math/b/c/9/bc910b5dfad511f293bc25876d8ca46c.png)