Die richtige Verbindung für umweltfreundliche Wirkstoffe
Chemiker entwickeln umweltschonende Methode zur pharmazeutischen Wirkstoffentwicklung
Anzeigen
Die Entwicklung von neuen Methoden in der organischen Synthese bildet die Grundlage für die Weiterentwicklung von pharmazeutischen Wirkstoffen, der Materialwissenschaft sowie der chemischen Biologie und spielt somit eine zentrale Rolle in unserem Alltag. Einem Forschungsteam um Nuno Maulide vom Institut für Organische Chemie an der Universität Wien gelang nun die Entwicklung der ersten hoch selektiven Methode zur direkten, abfallfreien Bindungsbildung zwischen Carbonylverbindungen und Alkenen.
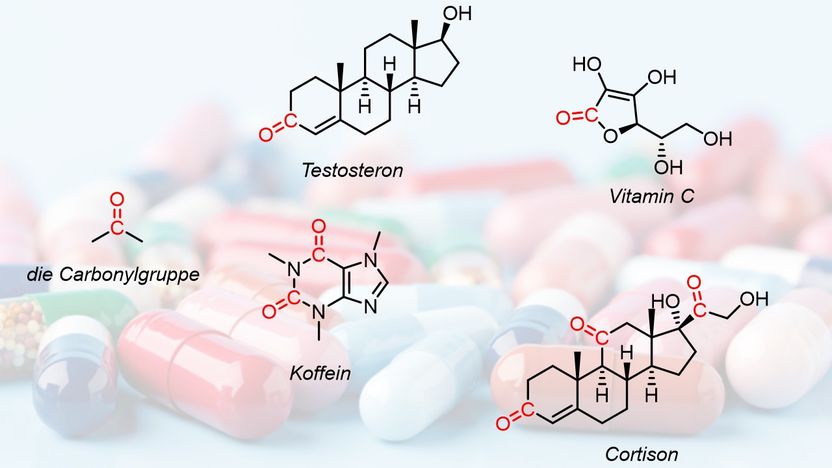
Die Carbonylgruppe
© Universität Wien/Maulide Group
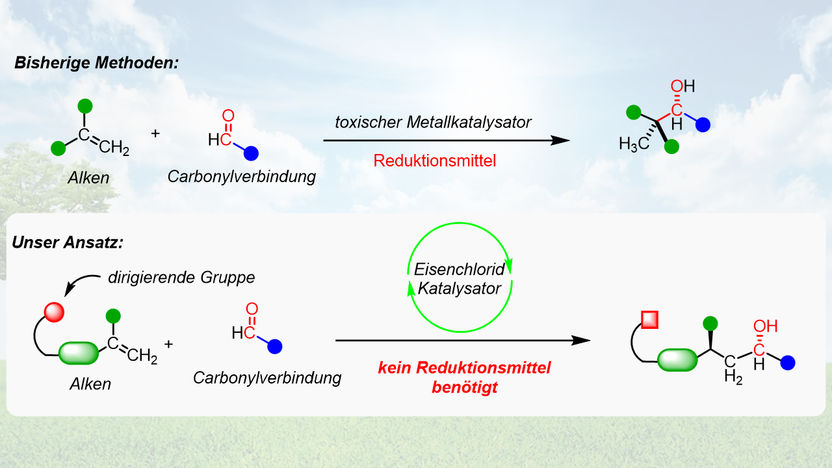
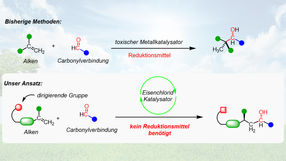
Ein neuer Ansatz ermöglicht erstmals die hoch selektive Kupplung von Carbonylen und Alkenen ohne Abfall zu generieren.
© Universität Wien/Maulide Group
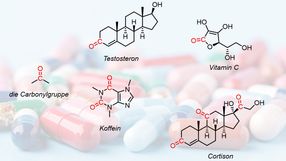
Die Carbonylgruppe findet man in verschiedensten Molekülen in unserem Körper, zum Beispiel in Hormonen wie Testosteron und Cortison, aber auch in Koffein und Vitamin C. Aufgrund dieser vielfältigen Vorkommen stellen die Verbindungen – welche immer eine charakteristische Kohlenstoff-Sauerstoff-Doppelbindung enthalten – auch eine wichtige Vorstufe für andere, höherwertige Verbindungen dar. "Üblicherweise werden für die Transformationen von Carbonylverbindungen metallbasierte Reagenzien verwendet. Diese sind allerdings hoch reaktiv, oft sogar pyrophor – beginnen also bei Kontakt mit Luftsauerstoff zu brennen – und generieren große Mengen an Abfall. Ein problematischer Zustand, bedenkt man die Wichtigkeit dieser Reaktionen", erklärt Jing Li, Co-Erstautor der Studien.
Die Vermeidung von eben solchen Reagenzien hat daher das Potential, die Chemie von Carbonylgruppen grundlegend zu revolutionieren. In jüngster Zeit zeigte sich die Addition von einfachen Rohstoffen wie Alkenen an Carbonylverbindungen zusehends als Alternative zu metallbasierten Reagenzien. "Bisher entwickelte Methoden für diese Reaktionen basieren allerdings auf teuren, giftigen Übergangsmetallkatalysatoren wie Ruthenium, Rhodium und Iridium: Alles Metalle, die oft unter fragwürdigen Bedingungen abgebaut werden – dazu werden auch verschiedenste Additive benötigt, die wiederum Abfall generieren", stellt Alexander Preinfalk vom Institut für Organische Chemie der Universität Wien fest. "Die von uns entwickelte Methode basiert auf günstigem, ungiftigem und absolut unbedenklichem Eisenchlorid als Katalysator. Zusätzlich kommt diese Methode ohne Additive aus und generiert somit kein einziges Abfallprodukt“, ergänzt Nuno Maulide, der 2019 zum Wissenschafter des Jahres gewählt wurde.
Das Forschungsteam bedient sich dabei eines chemischen Tricks: Einer sogenannten Hydrid-Verschiebung. "Zur Addition von Alkenen an Carbonylverbindungen benötigt man ein Reduktionsmittel. Dieses wird der Reaktion üblicherweise extern zugegeben und dann nach der Reaktion als Abfall ausgeschieden", erklärt Maulide. "Unsere Methode basiert auf einer Hydrid-Verschiebung, also einer Verschiebung eines negativ geladenen Wasserstoffatoms. Der Vorteil dabei ist, dass das Reduktionsmittel schon im Molekül vorhanden ist und somit kein Abfall entsteht."
Die Produkte können außerdem mit kompletter Kontrolle über die dreidimensionale Struktur hergestellt werden, was insbesondere für die pharmazeutische Wirkstoffentwicklung von entscheidender Bedeutung ist. Bisher was es aufgrund des Fehlens von selektiven Methoden enorm aufwendig, diese Carbonyl-Additionsprodukte kontrolliert zu erzeugen. "Wir haben im Rahmen unserer Studien Schlüsselintermediate für zwei biologisch aktive Verbindungen synthetisiert und für beide konnten wir die Länge des Synthesewegs im Vergleich zu bisherigen Routen halbieren – das ist ein beachtlicher Fortschritt", freut sich Maulide.
Originalveröffentlichung
"Enantioselective Redox-Neutral Coupling of Aldehydes and Alkenes by an Iron-Catalyzed "Catch–Release” Tethering Approach"; Jing Li, Alexander Preinfalk, Nuno Maulide; Journal of the American Chemical Society; 2019.
"Diastereo‐ and Enantioselective Access to Stereotriads through a Flexible Coupling of Substituted Aldehydes and Alkenes”; Jing Li, Alexander Preinfalk, Nuno Maulide; Angewandte Chemie International Edition; 2019.
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Synthese
Die chemische Synthese steht im Zentrum der modernen Chemie und ermöglicht die gezielte Herstellung von Molekülen mit spezifischen Eigenschaften. Durch das Zusammenführen von Ausgangsstoffen in definierten Reaktionsbedingungen können Chemiker eine breite Palette von Verbindungen erstellen, von einfachen Molekülen bis hin zu komplexen Wirkstoffen.

Themenwelt Synthese
Die chemische Synthese steht im Zentrum der modernen Chemie und ermöglicht die gezielte Herstellung von Molekülen mit spezifischen Eigenschaften. Durch das Zusammenführen von Ausgangsstoffen in definierten Reaktionsbedingungen können Chemiker eine breite Palette von Verbindungen erstellen, von einfachen Molekülen bis hin zu komplexen Wirkstoffen.































































