Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Aktivität (Chemie)Die Aktivität oder die thermodynamische Aktivität ist eine in der physikalischen Chemie wichtige, konzentrationsabhängige Größe, die in der Einheit mol/l angegeben wird. Die Aktivität stellt eine Art effektive Konzentration dar, die die Effekte der Nichtidealität der betreffenden Phase beinhaltet. Mathematisch gilt für die Aktivität a allgemein
Dabei ist x der Stoffmengenanteil des Stoffes. f ist ein dimensionsloser Korrekturfaktor, der Aktivitätskoeffizient. Diesen führte Gilbert Newton Lewis 1907 als rein empirische Größe für starke Elektrolyte ein. Physikalisch untermauert wurde dessen Theorie erst durch Berechnungen von Debye und Hückel. Die Aktivität spielt bei der Berechnung von Reaktionsgeschwindigkeiten und Energiegrößen einer chemischen Reaktion (s. chemisches Potential) eine wichtige Rolle. Produkt-Highlight
AktivitätskoeffizientIngenieurbereichIm technischen Bereich werden für die Abschätzung des Aktivitätskoeffizienten unter anderem NRTL, UNIQUAC und UNIFAC eingesetzt. ElektrochemieNach der Interpretation von Debye und Hückel ist Debye-Hückel: Darin ist R die universelle Gaskonstante und T die Temperatur. W ist negativ; somit liegt f zwischen 0 und 1. (die Theorie von Debye-Hückel verlangt eine starke Verdünnung von A) Experimentelle Messungen ergaben eine Abhängigkeit zwischen der Ionenkonzentration von A und seinem Aktivitätskoeffizienten. Für große Konzentrationen von A wird f größer als eins ("Ich gewinne Energie, wenn ich A entferne"). Große Ionenkonzentrationen von A werden von der Debye-Hückel-Theorie nicht berücksichtigt. Beispiel: Für 1 molare Essigsäure ist f beispielsweise 0.8, für 0.1 molare Essigsäure jedoch bereits 0.96. Aktivität eines LösungsmittelsIn Lösungen ist die Aktivität aB eines Stoffes B definiert über
wobei aB = γBxB mit Dieser Zusammenhang lässt sich aus dem chemischen Potential und dem Raoultschen Gesetz ableiten. GrenzaktivitätskoeffizientDer Grenzaktivitätskoeffizient Aktivität von Ionen und ElektrolytenFür verdünnte Elektrolyte lässt sich der Aktivitätskoeffizient aus der Debye-Hückel-Theorie berechnen. Dabei ist zu beachten, dass die oben angegebene Definitionsgleichung nur für jede individuelle Ionensorte i gilt
Da aber jede Lösung elektroneutral sein muss, das heißt gleich viele positive wie negative Ladungen aufweisen muss, können individuelle Aktivitäten zwar nutzbringend berechnet, aber nicht gemessen werden. Für einen nach der Gleichung
vollständig dissoziierenden Elektrolyten gilt, wenn wir die Indices + für die Kationen Zur Vereinfachung werden die mittlere Aktivität
und der mittlere Aktivitätskoeffizient
definiert.
Beispiele:
Siehe auch |
|||||
| Dieser Artikel basiert auf dem Artikel Aktivität_(Chemie) aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |


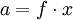


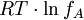 die elektrostatische potentielle Energie, die
entsteht, wenn man 1 Mol der Ionensorte A vom fiktiven ungeladenen Zustand auf seine reale Ladungsmenge innerhalb seiner entgegengesetzt geladenen Ionenwolke auflädt. Diese potentielle Energie ist somit negativ ( "Man muss Energie hineinstecken, um die Ionensorte A aus seiner Ionenwolke zu entfernen").
die elektrostatische potentielle Energie, die
entsteht, wenn man 1 Mol der Ionensorte A vom fiktiven ungeladenen Zustand auf seine reale Ladungsmenge innerhalb seiner entgegengesetzt geladenen Ionenwolke auflädt. Diese potentielle Energie ist somit negativ ( "Man muss Energie hineinstecken, um die Ionensorte A aus seiner Ionenwolke zu entfernen").
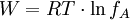
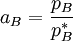
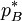 der Dampfdruck des reinen Lösungsmittels ist (der als Standardfugazität gewählt wird) ,
der Dampfdruck des reinen Lösungsmittels ist (der als Standardfugazität gewählt wird) , 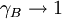 für
für 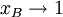
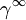 ist der Aktivitätskoeffizient einer Komponente bei unendlicher Verdünnung (
ist der Aktivitätskoeffizient einer Komponente bei unendlicher Verdünnung (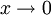 ) in einem Lösungsmittel oder einem Lösungsmittelgemisch.
) in einem Lösungsmittel oder einem Lösungsmittelgemisch.
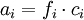
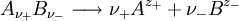
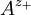 und - für die Anionen
und - für die Anionen 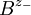 verwenden,
verwenden,
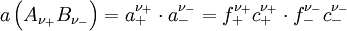
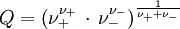
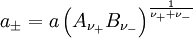
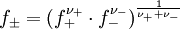
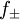 ist z. B. in
ist z. B. in 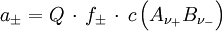
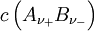 die Konzentration des Elektrolyten.
die Konzentration des Elektrolyten.
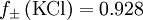 berechnet. Es ist
berechnet. Es ist 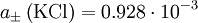 mol dm-3.
mol dm-3.
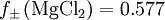 . Mit
. Mit ![Q=\left(1^1\cdot 2^2\right)^\frac{1}{1+2}=\sqrt[3]{4}](images/math/5/e/c/5eca8d5dceb109c24857e70e679f8630.png) ist also
ist also
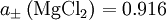 mol dm-3.
mol dm-3.


