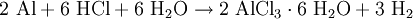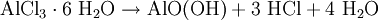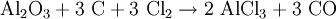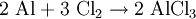Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Aluminiumchlorid
Aluminiumchlorid bildet farblose, hexagonale Kristalle. Es ist in vielen organischen Lösungsmitteln löslich. Das meist durch Verunreinigungen mit Eisenchloriden hellgelbe Pulver wirkt stark hygroskopisch. In feuchter Luft tritt es stark rauchend in Erscheinung. In Lösungsmitteln, flüssiger Phase sowie im Dampfzustand tritt Aluminiumchlorid in einer dimeren Form als Cl2AlCl2AlCl2 auf, in dem das Aluminiumatom vierfach koordiniert ist (analog zum Aluminiumbromid). Im festen Zustand ist im Aluminiumchlorid das Aluminium 6-fach durch Cl- koordiniert. Produkt-Highlight
ReaktionsverhaltenIn stark exothermer Reaktion kommt Aluminiumchlorid in Wasser in Lösung, wobei eine Hydrolyse in Chloridionen und Hexaaquaaluminiumkomplexe erfolgt: Diese Hexaaquaionen gehen schließlich in stark sauerer Reaktion in eine Hydroxyverbindung über: SyntheseWasserhaltiges Aluminiumchlorid (in rhombischen Kristallen auftretendes Hexahydrat AlCl3 · 6H2O) entsteht durch Auflösen von Aluminium in Salzsäure: Dieses Hexahydrat kann jedoch nicht entwässert werden, da es sich beim Erhitzen zu Aluminiumhydroxid bzw. Aluminiummetahydroxid und Chlorwasserstoffgas zersetzt: So muss die Herstellung von wasserfreiem Aluminiumchlorid durch Überleiten von Chlor über Kohlenstoff und Aluminiumoxid bei etwa 800°C oder direkt aus den Elementen erfolgen: beziehungsweise : VerwendungDas Hexahydrat des Aluminiumchlorids findet aufgrund seiner stark adstringierenden Wirkung in der Textil- und Seifenindustrie Verwendung, wo es unter anderem der Herstellung von antiseptischen Mitteln oder Deodoranten dient. Weiterhin wirkt es als starke Lewis-Säure sowie in der organischen Synthese als Katalysator bei Dehydrierungen, Polymerisationen und Friedel-Crafts-Reaktionen (Friedel-Crafts-Alkylierung, Friedel-Crafts-Acylierung). Außerdem wird es als Halogenüberträger und Kondensationsmittel verwendet. Im Bereich der Wasserchemie findet es als Primärflockungs- und Fällungsmittel (z.B. für Phosphate in Kläranlagen) Anwendung. Zudem kann Aluminiumchlorid in bestimmten Konzentrationen durch lokales Auftragen gegen übermäßiges Schwitzen benutzt werden. Gegen leichte Entzündungen im Rachenraum werden Aluminiumchloridhaltige Lösungen zum Gurgeln angeboten. BesonderheitAluminiumchlorid wird als der Grenzfall zwischen Molekül und Ion angesehen, es hat eine delta-EN von 1,55 (nach Pauling). Damit sollte es sich eigentlich um eine polare Atombindung handeln. Man bekommt es in Apotheken. QuellenKategorien: Ätzender Stoff | Chlorid | Aluminiumverbindung |
|||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Aluminiumchlorid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||||






![\mathrm{AlCl_3 + 6 \, H_{2}O \rightarrow [Al(H_{2}O)_{6}]^{3+} + 3Cl^-}](images/math/9/5/2/9521270f40c7a532ea520d3b1cf33023.png)
![\mathrm{[Al(H_{2}O)_{6}]^{3+} + H_{2}O \rightarrow [Al(H_{2}O)_{5}OH]^{2+} + H_{3}O^+}](images/math/9/b/2/9b227a92610bb307e914d668069de119.png)