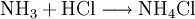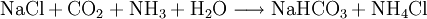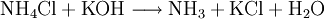Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Ammoniumchlorid
Ammoniumchlorid (NH4Cl) ist ein weißes, gut wasserlösliches Salz, welches kubische Kristalle bildet. Mit steigender Temperatur dissoziiert Ammoniumchlorid zunehmend zu Ammoniak und Chlorwasserstoff. Bei 340 °C sublimiert der Stoff vollständig. Unter Druck (34,4 bar) schmilzt Ammoniumchlorid bei 520 °C. Als Lebensmittelzusatz trägt es die Nummer E 510. Produkt-Highlight
VorkommenNatürlich vorkommendes Ammoniumchlorid ist als Mineral Salmiak bekannt und verbreitet. Der Name "Salmiak" leitet sich von lat. "sal ammoniacum" (Salz des Ammon, siehe auch Namensherkunft von Ammoniak) ab, da es im Altertum in der Nähe eines Ammon-Tempels im heutigen Ägypten vorkam und mit Halit (Steinsalz) verwechselt wurde. Gewinnung und DarstellungAmmoniumchlorid kann durch Neutralisation von wässriger Ammoniaklösung mit Salzsäure oder durch die Reaktion von gasförmigem Ammoniak mit gasförmigen Chlorwasserstoff gewonnen werden. Es kann durch Umkristallisieren aus Wasser gereinigt werden. Ammoniumchlorid fällt als Nebenprodukt bei der Gewinnung von Soda nach dem Solvay-Verfahren an. EigenschaftenAmmoniumchlorid ist gut in Wasser löslich. Wässrige Lösungen reagieren sauer. Der pH-Wert einer 1%igen Lösung beträgt etwa 5,5. Es ist schlecht in Ethanol löslich und unlöslich in Aceton und Ether. Beim Versetzen von Ammoniumchlorid mit starken Basen wird gasförmiges Ammoniak freigesetzt. VerwendungVerwendung findet Ammoniumchlorid heute unter anderem zur Herstellung von Kältemischungen, in der Färberei und Gerberei. Ebenfalls findet es Anwendung beim Verzinnen, Verzinken oder Löten, da es die Fähigkeit besitzt, mit Metalloxiden flüchtige Chloride zu bilden und somit die Metalloberfläche zu reinigen. Des Weiteren dient es in der Medizin als Expektorans und wird als Elektrolyt in Zink-Kohle-Batterien eingesetzt; außerdem in Salmiak-Lakritz. Es ist auch häufig in Rauchpulver (weiß) vorhanden. Quellen
Literatur
Kategorien: Gesundheitsschädlicher Stoff | Reizender Stoff | Ammoniumverbindung | Chlorid | Kubisches Kristallsystem |
||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Ammoniumchlorid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||||