Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Cyanwasserstoff
Cyanwasserstoff (Blausäure) ist eine farblose bis leicht gelbliche, brennbare und wasserlösliche Flüssigkeit mit einem charakteristischen, unangenehmen Geruch nach Bittermandeln. Der „Bittermandelgeruch“ von Mandeln und anderen Kernen setzt sich zusammen aus dem angenehmen Duft von Benzaldehyd und dem eher unangenehmen Geruch der Blausäure. Der Geruch ist auch mit Marzipan zu vergleichen. Ursprünglich ist in den Mandelkernen ein cyanogenes Glykosid, das Amygdalin, vorhanden, das unter dem Einfluss des Enzyms Hydroxynitrillyase oder Säuren in Blausäure, Benzaldehyd und Glukose zerfällt. Etwa 50–70 % der Menschen sind – aufgrund ihrer genetischen Veranlagung – in der Lage, den Geruch von Blausäure wahrzunehmen.[4][5] Der Name Blausäure rührt von der Gewinnung aus Eisenhexacyanoferrat (Berliner Blau) her, einem nicht sehr beständigen Pigment mit blauer Farbe. „Blausäure“ ist auch der Titel eines Kriminalromanes von Agatha Christie. Die Originalausgabe erschien 1945 unter dem Titel „Sparkling Cyanide“. Produkt-Highlight
EigenschaftenDie Salze der Blausäure heißen Cyanide. Blausäure ist eine sehr schwache Säure, die schon von Kohlensäure aus ihren Salzen getrieben wird. Als pKs wird meist 9,31, gelegentlich auch 9,21 oder 9,04 angegeben. Cyanide, Salze der Blausäure (Kaliumcyanid), wirken bei der Hydrolyse basisch/alkalisch. Die Salzsäure im menschlichen Magen setzt daher aus Cyaniden Cyanwasserstoff frei. Blausäure ist sowohl leicht brennbar als auch in jedem Verhältnis wasserlöslich. Bei einem Brand mit Anwesenheit von Blausäure wird empfohlen, nicht mit Wasser zu löschen und gegebenenfalls die Blausäure kontrolliert abbrennen zu lassen. Ein Gemisch aus Luft und Cyanwasserstoffgas ist im Bereich von 5,4–46,6 Vol.-% hochexplosiv. Reine wasserfreie Blausäure kann spontan polymerisieren, speziell in Gegenwart kleiner Mengen von basischen Stoffen. Diese Reaktion ist stark exotherm. Es entsteht ein braunes Polymer, die Polymerisation ist nicht reversibel. In Wasser dissoziert Blausäure zu einem kleinen Teil: GiftwirkungenBlausäure sowie alle Cyanide sind sehr giftig. Blausäure verdunstet bei Raumtemperatur schnell. Eine Vergiftung kann deshalb durch Einatmen (inhalativ) erfolgen. Schon 1-2 mg Blausäure pro kg Körpergewicht wirken tödlich. Eine Resorption über die Haut ist möglich, sie wird durch körperliche Arbeit (welche mit Schweiß verbunden ist) begünstigt, da Blausäure eine hohe Wasserlöslichkeit besitzt. Die primäre Giftwirkung besteht in der Blockade der Sauerstoff-Bindungsstelle durch eine irreversible Bindung des Cyanids an das zentrale Eisen(III)-Ion des Häm a3 Kofaktors in der Cytochrom c Oxidase der Atmungskette in den Mitochondrien der Zelle. Durch die Inaktivierung dieses Enzyms kommt die Zellatmung zum Erliegen, die Zelle kann den Sauerstoff nicht mehr zur Energiegewinnung verwerten und es kommt damit zur sog. „inneren Erstickung“. Die Bindung des Cyanids an Eisen(II)-Ionen ist vergleichsweise gering. Die Inaktivierung des Hämoglobins durch Bindung des Eisen(II)-Ions spielt daher bei Vergiftungen eine untergeordnete Rolle. Im Gegensatz zur landläufigen Meinung ist eine hellrote Färbung der Haut ein typisches Anzeichen einer Vergiftung mit Cyaniden: Das venöse Blut ist noch mit Sauerstoff angereichert, da der Sauerstoff von den Zellen nicht verwertet werden konnte. Aus gleichem Grund finden sich nach dem Tod durch Blausäure bei dem Toten Leichenflecke (Livores), die ähnlich denen bei Vergiftung durch Kohlenstoffmonoxid leuchtend rot sind, neben dem genannten Bittermandelgeruch ein wichtiges Indiz auf einen nicht natürlichen Tod bei der Leichenschau. Bei einer Vergiftung mit sehr hohen Konzentrationen kommt es in Sekunden zur Hyperventilation, Atemstillstand, Bewusstlosigkeit und innerhalb von wenigen Minuten zum Herzstillstand. Eine hellrote Färbung der Haut bleibt in diesen Fällen oft aus. VergiftungssymptomeSymptome für eine Vergiftung sind unter anderem:
30 bis 50 % der Menschen können den Geruch von Blausäure (den durch Kriminalromane bekannt gewordenen Bittermandelgeruch) genetisch bedingt nicht wahrnehmen.[4][5] Es müssen daher besondere Sicherheitsmaßnahmen beim Umgang mit Blausäure getroffen werden. Erste Hilfe
Tödlicher Einsatz von Blausäure
Blausäure als KampfmittelAls Giftgas wurde Blausäure erstmals durch die französische Armee am 1. Juli 1916 eingesetzt. Dieser Einsatz blieb nicht nur wegen neuartiger Filter in den Gasmasken der deutschen Gegner wirkungslos. Die Brauchbarkeit von Blausäuregas als Kampfstoff erwies sich als mangelhaft, weil sich das Gas sehr rasch verflüchtigte. Nach diesem Misserfolg wurde Blausäuregas als Kampfmittel nicht weiter verwendet. Bei modernen chemischen Kampfstoffen kann Blausäure jedoch als sogenannter Maskenbrecher hinzugefügt sein, um die Resorptionsfähigkeit des Filters übermäßig schnell zunichte zu machen und so dem eigentlichen Kampfstoff zur Wirkung zu verhelfen. Antidot (Gegengift)Bei Cyanid-Vergiftungen wird zunächst 4-Dimethylaminophenol (4-DMAP) als Antidot eingesetzt. Dieses wandelt Fe(II) in Fe(III) um, was zu einer Methämoglobin-Bildung führt. Das Methämoglobin bindet die Cyanidionen. Gemessen am gesamten Hämoglobin genügt schon eine geringe Menge an Methämoglobin, um einen großen Teil des Cyanids zu binden. Die Wirkung dieses Gegenmittels hängt allerdings von der Hämoglobinkonzentration im Blut ab. Bei Brandgasinhalation muss unbedingt beachtet werden, dass durch eine gleichzeitig vorliegende Kohlenmonoxidvergiftung größere Mengen Hämoglobin bereits gebunden sind und keinen Sauerstoff mehr transportieren können. Dies birgt bei der Behandlung, die bis zu einem Drittel des Hämoglobins umwandelt, die große Gefahr einer tödlichen Hypoxie. Speziell für diese Fälle wird Hydroxycobalamin verwendet, welches unter dem Handelsnamen Cyanokit® in der EU seit 29. Nov 2007 zugelassen ist. Für dieses Antidot bestand bisher keine offizielle Zulassung in Deutschland, es wurde aber in einzelnen Regionen versuchsweise verwendet (etwa Berufsfeuerwehr München). Zu beachten ist hier jedoch, dass eine Lebensrettung nur bei 100%ig nüchternem Zustand (auch kein Restalkohol im Blut) Chancen auf Erfolg verspricht. Die Wirkung des Hydroxycobalamin besteht darin, dass es mit Cyanidionen starke Komplexe eingeht, und somit das Cyanid bindet. Da viele Nahrungsmittel Cyanwasserstoff in geringen Konzentrationen enthalten, besitzt der Mensch das Enzym Rhodanase, welches Blausäure in den ungefährlichen Stoff Rhodanid umwandelt. Das Medikament Natriumthiosulfat liefert den für diese Reaktion benötigten Schwefel und sollte bei Cyanid-Vergiftung sofort anschließend an das 4-DMAP verabreicht werden. Als weitere Maßnahme könnte Isoamylnitrit zur Inhalation verabreicht werden, welches ebenfalls eine Methämoglobinbildung bewirkt; diese Maßnahme sollte wegen der Gefahr eines starken Blutdruckabfalls allerdings nur mit Vorsicht angewandt werden. In Deutschland befindet sich kein Präparat mit diesem Wirkstoff auf dem Markt; andere NO-Donatoren wie Glyceroltrinitrat bewirken nur eine sehr geringe Methämoglobinbildung und sind nicht als Antidot geeignet. Natürliches VorkommenDie Kerne einiger Steinobstfrüchte (Mandel, insbesondere Bittermandel, Aprikose, Pfirsich, Kirsche) und anderer Rosengewächse enthalten geringe Mengen an Blausäure, diese dient vermutlich als Fraßschutz der Samen. Die in den Tropen vielfach als Nahrungsmittel genutzte Knolle des Maniok enthält ebenfalls als cyanogenes Glykosid gebundene Blausäure, die durch die Verarbeitung vor dem Verzehr der Pflanze entfernt wird. Weitere wichtige Nahrungsmittel mit toxikologisch relevanten Blausäuregehalten sind Yamswurzel, Süßkartoffel, Zuckerhirse, Bambus, Leinsamen und Limabohne. Unreife Bambussprossen, die in östlichen Ländern als Delikatesse gelten, enthalten hohe Blausäuregehalte, Vergiftungsfälle sind bekannt. Durch Zubereitung (intensives Kochen) wird die Blausäure von den Glykosiden abgespalten und in die Luft abgegeben. Cyanogene Pflanzen sind weit verbreitet unter den höheren Pflanzen und können bei Verletzung des Pflanzengewebes durch Pflanzenfresser HCN aus cyanogenen Glykosiden mittels des Enzyms Hydroxynitrillyase freisetzen. Dabei handelt es sich natürlich um Giftpflanzen. Einige Beispiele für cyanogene Pflanzen sind der tropische Goldtüpfelfarn (Phlebodium aureum), ein Mitglied der Tüpfelfarngewächse, oder der brasilianische Gummibaum (Hevea brasiliensis). Einer der bekanntesten Stoffe, die Blausäure abspalten und in den Pflanzen vorkommen (Aprikosenkerne) ist Amygdalin. Kulturelle VorkommenBlausäure wird in vielen Prozessen in der Industrie und im Bergbau eingesetzt, beispielsweise zum Auslaugen von Gold: Die Gold-Lösung wird dann mit Zink reduziert. (Wegen der besseren Handhabung wird hierbei nicht flüssige Blausäure, sondern eine Cyanidlösung eingesetzt.) Dieses Verfahren führt, wie auch das alternativ eingesetzte Quecksilber-Amalgamverfahren, zu den oft katastrophalen Gewässervergiftungen in den Goldfördergebieten der Dritten Welt. Blausäure wird bei falschen Bedienschritten in der Galvanik frei. Blausäure ist auch ein wichtiger Ausgangsstoff für viele Erzeugnisse der organischen Chemie. In der Regel wird die Blausäure am Ort ihrer Herstellung sofort weiterverarbeitet, damit ein Transport dieses Gefahrstoffes nach Möglichkeit vermieden wird. Beim Verbrennen stickstoffhaltiger Polymere (Kunststoffe) kann in erheblichem Umfang Blausäure entstehen. Auch beim Rauchen von Tabak entsteht etwas Blausäure. Herstellung und VerwendungFür die Herstellung von Blausäure sind folgende Verfahren von Bedeutung
Blausäure wird in großen Mengen zur Herstellung von Adiponitril und Acetoncyanhydrin, beides Zwischenprodukte der Kunststoffproduktion, verwendet. Bei der Adiponitril Herstellung wird Blausäure mittels eines Nickel-Katalysators an Butadien addiert (Hydrocyanierung). Zur Acetoncyanhydrinherstellung wird Blausäure katalytisch an Aceton addiert. Unfälle im Umgang mit Blausäure
Nachweis
SchutzmaßnahmenSchutzhandschuhe, Staubmaske, Atemschutz Gasfilter B. Bei allen Arbeiten im Labor, bei denen mit dem Auftreten von Blausäure gerechnet werden muss, ist unbedingt im Abzug zu arbeiten. LagerungKühl, unter striktem Sauerstoff- und Feuchtigkeitsausschluss. Quellen
Siehe auch
Kategorien: Feuergefährlicher Stoff | Giftiger Stoff | Umweltgefährlicher Stoff | Cyanid | Wasserstoffverbindung | Pseudohalogen |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Cyanwasserstoff aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||||||||


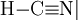






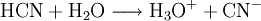
![\mathrm{4 \ Au + 8 \ HCN + O_2 + 4 \ OH^- \longrightarrow 4 \ [Au(CN)_2]^- + 6 \ H_2O}](images/math/d/d/1/dd10d69d2d8dd27b890360d3ea2aed09.png)


