Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Wasserdampf
In der Umgangssprache versteht man unter Wasserdampf meist die sichtbaren Dampfschwaden von teilweise bereits kondensierendem Wasserdampf (Nassdampf), wie er auch als Nebel oder in Wolken vorkommt. Im technisch-naturwissenschaftlichen Kontext ist Wasserdampf gasförmiges Wasser, das in diesem Aggregatzustand unsichtbar ist wie Luft. In diesem Zusammenhang wird auch nicht von Wassergas gesprochen, da dieser Begriff anders belegt ist.
Produkt-HighlightEntstehung und ZuständeBei einem normalen Umgebungsdruck von 1,013 bar (101,325 kPa) siedet Wasser bei 100° Celsius. Wird dem verbliebenen Wasser darüber hinaus Energie (Wärme) zugeführt, verdampft es, ohne dass es zu einem weiteren Temperaturanstieg kommt. Aus 1 Liter (entsprechend 1 kg) Wasser entstehen 1,673 m³ Wasserdampf, wofür eine Energiezufuhr von 2.257 kJ benötigt wird. Im Gleichgewichtszustand entspricht der Dampfdruck immer dem äußeren Druck (gegebenenfalls dem Umgebungsdruck). Die zugeführte Energie erhöht die innere Energie des Dampfes um 2.088 kJ und leistet gegenüber dem Umgebungsdruck eine Volumenänderungsarbeit W. Beide Beiträge ergeben die Verdampfungsenthalpie H, die sich in einem Enthalpie-Entropie-Diagramm (h-s-Diagramm) als Differenz auf der y-Achse als spezifische Größe ablesen lässt. Das hier abgebildete T-s-Diagramm stellt die für die Verdampfung (bei 100°C) notwendige Wärme in Form der gepunkteten blauen Fläche dar. Ebenso lässt sich dabei der Zuwachs an Verdampfungsentropie ΔS (Delta S) ermitteln:
ErscheinungsformenDer Dampfdruck des Wassers ist temperaturabhängig. Bei Temperaturen unterhalb des Siedepunktes spricht man von Verdunstung. In gesättigter Umgebungsluft stellt sich ein Gleichgewicht zwischen verdunstendem Wasser und kondensierendem Wasserdampf ein. Die Übergangsbedingungen zwischen flüssigem Wasser und Wasserdampf sind in der Siedepunktkurve des Zustandsdiagramms dargestellt, welche in der rechten Abbildung dargestellt ist. NaßdampfWenn Wasser in einer kälteren Umgebung unter Zufuhr von Wärme verdampft, kondensieren Teile des gasförmigen Wassers wieder zu feinsten Tröpfchen. Der Wasserdampf besteht dann aus diesen und gasförmigem, unsichtbarem Wasser. Diese Mischung bezeichnet man als Nassdampf, der zum Beispiel beim Wasserkochen sichtbar wird. Im T-s-Diagramm erstreckt sich der Bereich des Nassdampfes bis zum kritischen Punkt bei 374 °C und 221,2 bar. Der Inhalt des Nassdampfes an flüssigem Wasser ist durch den Massenanteil x gekennzeichnet, der sich mit folgender Formel berechnen lässt:
HeißdampfOberhalb dieser Temperatur sind Wasserdampf und flüssiges Wasser in ihrer Dichte nicht mehr voneinander zu unterscheiden, weshalb dieser Zustand als „überkritisch“ bezeichnet wird. Überkritisches Wasser hat chemisch gesehen besonders aggressive Eigenschaften. Es wurden daher Versuche unternommen, mit dessen Hilfe biologisch schwer abbaubare organische Schadstoffe, wie z. B. Dioxine, PCB etc., hydrolytisch zu spalten. Unterhalb des kritischen Punktes ist der Wasserdampf folglich „unterkritisch“, wobei er sich in einem Gleichgewicht mit dem flüssigen Wasser befindet. Wird er in diesem Bereich nach dem vollständigen Verdampfen der Flüssigkeit über die zugehörige Verdampfungstemperatur weiter erwärmt, so entsteht „überhitzter Dampf“ oder „Heißdampf“. Diese Form des Dampfes enthält keine Wassertröpfchen mehr und ist in ihrem physikalischen Verhalten ebenfalls ein Gas und nicht sichtbar. Sattdampf oder TrockendampfDer Grenzbereich zwischen Nass- und Heißdampf heißt „Sattdampf“ oder in Abgrenzung zum Nassdampf gelegentlich auch „Trockendampf“. Auf diesen Zustand sind die meisten Tabellenwerte über Wasserdampf bezogen. x = 0 und x = 1Eine besondere Bedeutung kommt den beiden Grenzkurven x = 0 und x = 1 im T-s-Diagramm zu, die sich im kritischen Punkt treffen: Die Kurve x = 0 grenzt das Gebiet der Flüssigkeit vom Nassdampf ab, während die Kurve x =1 den Nassdampf vom Heißdampf trennt und gleichzeitig den Zustand des Sattdampfes markiert. Andere Bezeichnungen für die Kurve x=0 sind Siedelinie oder untere Grenzlinie, die Kurve x=1 wird auch Taulinie, Sattdampfkurve oder obere Grenzlinie genannt. Die Schreibweise mit x für den Massenbruch ist hierbei nicht einheitlich definiert, da vor allem in der Chemie der Massenanteil mit w angegeben wird und x hier mehrheitlich für den Stoffmengenanteil steht. Da beide Größen ineinander umrechenbar sind und sich in den Grenzwerten 0 und 1 gleichen, spielt dies hier eine untergeordnete Rolle.
ErscheinungGasförmiger oder überhitzter Wasserdampf ist farblos und damit unsichtbar, wie die meisten Gase. Nassdampf ist durch die mitgerissenen Wassertropfen dagegen sichtbar. Bei Kontakt mit hinreichend kühler Umgebungsluft kommt es zur Unterschreitung des Taupunktes und folglich zu einer Kondensation weiterer feinster Wassertropfen. An ihnen wird Licht gestreut, so dass dadurch die Existenz des Wasserdampfs in der Luft sichtbar wird. Wasserdampf kann auch direkt, ohne den Umweg über die Flüssigkeit, aus der festen Phase von Wasser entstehen: aus Eis oder Schnee. Dieses Phänomen kann in der Natur bei extrem trockener Luft im Hochgebirge beobachtet werden, wenn verschneite Hänge bei Temperaturen von weit unter 0 °C mit der Zeit schneefrei werden. Hierbei entsteht der Wasserdampf durch Sublimation: die Luftfeuchte nimmt durch Abdampfen aus dem Schnee zu, und zuvor verschneite Flächen apern aus, ein bekanntes Phänomen z. B. im Himalaya. Aus den selben Ursachen trocknet im Freien aufgehängte Wäsche auch wenn es friert. Das Bild zeigt, wie in der Luft unsichtbar vorhandener Wasserdampf unter besonderen Bedingungen kondensiert und damit sichtbar wird, z. B. wenn ein Flugzeug die Schallmauer in Bodennähe durchbricht. Der Wasserdampf im heißen Abgas wird hingegen von der sich erwärmenden Luft aufgenommen. SiedenIn Abhängigkeit von der Wärmestromdichte, die siedender Flüssigkeit über eine Heizfläche zugeführt wird, bilden sich unterschiedliche Siedeformen aus. Wenn die Temperatur der Heizfläche über der Siedetemperatur liegt bilden sich an Riefen oder Kratzern Blasenkeime. Bis zu Wärmestromdichten von 2 kW/m2 bilden sich Blasen die beim Hinaufsteigen wieder kondensieren. Diese Siedeform wird als stilles Sieden bezeichnet. Die Oberflächentemperatur der Heizfläche liegt einige Grad über der Siedetemperatur. Mit steigender Wärmestromdichte nimmt die Blasenbildung zu und die Blasen erreichen die Oberfläche. Die an den Heizflächen abreißenden Blasen führen zu einem hohen Wärmeübergangskoeffizienten. Die Wandtemperaturen steigen nicht wesentlich über die Siedetemperatur (bis etwa 30K). Beim Blasensieden können Wärmestromdichten bis 1000 kW/m2 erreicht werden. Wird die Wärmestromdichte dann noch weiter gesteigert, setzt sprunghaft das Filmsieden ein: es bildet sich ein durchgehender Dampffilm. Dieser wirkt wie eine Isolierschicht und der Wärmeübergangskoeffizient wird drastisch reduziert. Wird der Wärmestrom nicht reduziert, so wird erst dann wieder ein Gleichgewichtszustand erreicht, wenn die Wärme durch ausreichend hohe Wärmestrahlung abgegeben werden kann. Dieser Zustand wird aber erst bei einer Überhitzung der Heizflächentemperatur von ca. 1000K erreicht. In der Regel wird bei diesem Übergang vom Blasensieden zum Filmsieden die Heizfläche zerstört. Um einer Zerstörung von Heizflächen an Dampfkesseln vorzubeugen wird die maximale Wärmestromdichte auf 300 kW/m2 begrenzt. Tabellen, Diagramme und FormelnWegen seiner enormen Bedeutung für die Energiewirtschaft zählt Wasserdampf zu den am besten erforschten Stoffen innerhalb der Thermodynamik. Seine physikalischen Eigenschaften wurden durch Messungen und Berechnungen bestimmt und in umfangreichen Tabellenwerken, den so genannten Wasserdampftafeln, erfasst. T-s-Diagramm
h-s-DiagrammBei einem Mollier-Diagramm wird die Entropie des Dampfes auf der x-Achse und die zugehörige Enthalpie auf der y-Achse aufgetragen. Die grundlegenden physikalischen Eigenschaften des Wasserdampfes lassen sich hier nicht so einfach interpretieren, jedoch können die zur Zustandsänderung des Dampfes nötigen Wärmemengen, also beispielsweise die Verdampfungsenthalpie, direkt von der y-Achse abgelesen werden.
Magnus-FormelEine Näherungsformel für die Berechnung des Sättigungsdampfdruckes in Abhängigkeit von der Temperatur ist die Magnus-Formel: mit der Temperatur θ in °C und den Koeffizienten Diese Formel ist sehr genau (< 0,22 %) im Bereich zwischen 0 und 100 °C und immer noch gut (<4,3 %) zwischen -20 und 374 °C (maximaler Fehler bei 290 °C). Sie wird wegen ihres einfachen Aufbaues und wegen ihrer hohen Genauigkeit bei den auf der Erde üblichen Temperaturen der Luft vor allem in der Meteorologie und in der Bauphysik zur Taupunktbestimmung verwendet. Mit leicht unterschiedlichen Koeffizienten ergeben sich Werte, die auf 0,1 % mit der in DIN 4108 abgedruckten Tabelle für bauphysikalische Berechnungen übereinstimmt. Die Magnus-Formel wurde von Heinrich Gustav Magnus auf empirischem Weg, das heißt durch Messungen, gefunden und seitdem lediglich durch genauere Werte ergänzt. Eine aus der Thermodynamik abgeleite Gesetzmäßigkeit für Phasendiagramme stellt die Clapeyron-Gleichung bzw. die Clausius-Clapeyron-Gleichung dar. Aufgrund vieler praktischer Probleme in Bezug auf diese eher theoretischen Gleichungen, stellt die Magnus-Formel jedoch trotzdem die beste bzw. praktischste Näherung dar. Durch eine Anpassung der Werte auf ein Genauigkeitsoptimum in anderen Temperaturbereichen ließe sich bei Bedarf mit der Magnus-Formel auch bei diesen Temperaturen eine bessere Näherung ermöglichen. Näherungs-FormelEine brauchbare Faustformel für die Berechnung der Sattdampftemperatur aus dem Sattdampfdruck und umgekehrt ist:
wenn man den Druck p in bar(absolut) einsetzt. Die zugehörige Temperatur θ ergibt sich in Grad Celsius; diese Formel ist im Bereich p kr. > p > p = 3bar (200°C > θ > 100°C) auf etwa drei % genau. Beeinflussung des KlimasIm terrestrischen Wettergeschehen spielt Wasserdampf eine entscheidende Rolle. Ein Kilogramm Luft kann bei 30 °C und 1 bar Druck etwa 26 Gramm Wasserdampf als Luftfeuchtigkeit aufnehmen. Diese Menge fällt beispielsweise bei 10 °C auf etwa 7,5 g/kg ab. Die überschüssige Menge wird als Niederschlag in Form von Tau, Reif, Raureif, Nebel, Schnee, Hagel oder Regen aus der Luft ausgeschieden. Durch die Bildung von Wolken aufgrund des kondensierenden Wasserdampfs wird eine starke Dämpfung der Sonneneinstrahlung auf die Erde hervorgerufen. Der in der Erdatmosphäre vorhandene Wasserdampf ist zudem ein Treibhausgas und zu einem großen Teil (66 %) für den natürlichen Treibhauseffekt verantwortlich. Dieser für den Strahlungshaushalt der Erde wichtige Effekt hat eine Erhöhung der globalen Durchschnittstemperatur von etwa -18 °C auf ein Niveau von 15 °C zur Folge. Das Leben auf der Erde wird dadurch überhaupt erst möglich. An der globalen Erwärmung ist Wasserdampf verstärkend, aber nicht ursächlich beteiligt, d.h. dass der bloße Ausstoß von Wasserdampf nicht zur Erwärmung der Erde beiträgt, im Gegensatz zur Emission von Gasen wie Kohlenstoffdioxid. In der Stratosphäre vorhandene Spuren von Wasserdampf gelten andererseits als besonders klimaschädlich. Die Klimaforscher beobachteten in den letzten 40 Jahren einen Zuwachs des Wasserdampfs in der Stratosphäre von 75 % (siehe polare Stratosphärenwolken) und machen diesen für die Erhöhung der mittleren Erdtemperaturen mitverantwortlich. Die Herkunft des Wasserdampfs in diesen Höhen ist noch unklar, man vermutet jedoch einen Zusammenhang mit der in den letzten Jahrzehnten stark gestiegenen Methanproduktion im Rahmen der industriellen Landwirtschaft. Methan wird in diesen großen Höhen zu Kohlendioxid und Wasserdampf oxidiert, womit allerdings nur die Hälfte des Zuwachses zu erklären ist. Natürliches VorkommenReiner Wasserdampf kommt in der Natur auf der Erde in Vulkanen, Fumarolen und bei Geysiren vor. Hierbei ist er der wichtigste Parameter bei vulkanischen Eruptionen und bestimmt deren Charakter mit. Es ist dabei maßgebend, dass viele Minerale bzw. Gesteine Wasser oder andere flüchtige Stoffe in ihr Kristallgitter einbinden, besonders unter der Wirkung hoher Drücke. Da Magma beim Aufsteigen in der Kruste eine Druckentlastung erfährt, treibt der Wasserdampf zusammen mit anderen Fluiden aus dem Magma aus und bildet Blasen, welche durch den Druck zunächst jedoch nicht frei expandieren. Unterschreitet der Druck einen bestimmten Wert, so verbinden sich diese Fluidblasen jedoch und führen zu einer Art enormen Siedeverzug, werden also explosionsartig frei. Dabei reißen sie auch größere Mengen Magma mit und verursachen die vergleichsweise seltenen explosiven Vulkanausbrüche. Da der Anteil an Fluiden in den Gesteinen bei konvergierenden Plattengrenzen besonders groß ist, zeigt sich bei diesen auch die deutlichste Tendenz für diesen Vulkantyp. Wasserdampf ist zudem ein wichtiges Hilfsmittel für den menschlichen Wärmehaushalt. Bei hohen Umgebungstemperaturen wird zur Thermoregulation durch Schwitzen die überschüssige Körperwärme (Verdunstungskälte) an die Umgebung abgegeben. Die dabei umgesetzten Wärmemengen sind erheblich, zur Verdunstung eines Gramms Schweiß werden 2,43 kJ Wärme benötigt. Der gesunde Mensch erzeugt bei normalen Umgebungstemperaturen täglich etwa 500 g Wasserdampf durch Schwitzen, hinzu kommt noch einmal die doppelte Menge mit der ausgeatmeten Atemluft. Mit dieser Menge wird die Körpertemperatur auf 37 °C geregelt. Wasserdampfeintrag
Bei der Verbrennung von Erdölprodukten werden die Kohlenwasserstoffe der Erdölfraktionen im wesentlichen in Kohlenstoffdioxid und Wasserdampf umgesetzt. Im Autoverkehr sind dies Benzin und Diesel, im Luftverkehr Kerosin, in der Hausheizung Heizöl und in der Industrie Schweröle. Der im Abgas enthaltene kondensierende Wasserdampf macht sich beim Flugzeug durch Kondensstreifen am Himmel bemerkbar. Bei der Verbrennung von Erdgas, das mittlerweile zur Heizung von Gebäuden verwendet wird, fällt wegen der vier Wasserstoffatome im Methanmolekül doppelt soviel Wasserdampf wie Kohlenstoffdioxid an. Dies ist der Grund dafür, dass Brennwertgeräte für Erdgas effektiver arbeiten als für Heizöl. Wasserdampf wird bei vielen großtechnischen Prozessen als Abfallprodukt in die Atmosphäre eingetragen. Als Abwärme wird Wasserdampf auch in der Wasserstoffwirtschaft auftreten. Wasserdampf in der KlimatechnikEine Klimaanlage ist eine Gebäudeausstattung, die einen definierten Wasserdampfgehalt der Luft garantiert. Um Fertigprodukte aus Eisen- und Stahlwerkstoffen vor Korrosion, Lagerbestände wie Bücher vor Verwitterung und Lebensmittel vor Austrocknung zu schützen, werden Lagerhallen klimatisiert. In der Wohnraumklimatisierung trägt der Wasserdampfgehalt in erheblichem Maße zum Wohlbefinden des Menschen bei. Bei der Beurteilung der Raumluft spielt der Begriff der Behaglichkeit eine zentrale Bedeutung; ein Aspekt ist der als angenehm empfundene Zusammenhang zwischen Raumlufttemperatur und relativer Luftfeuchtigkeit. Dieser wird von einer Klimaanlage sichergestellt. Quantifizierung von WasserdampfDa der Wasserdampf bei verschiedensten Gegebenheiten und Prozessen eine große Rolle spielt, wird er mit unterschiedlichsten Messmethoden bzw. -geräten erfasst und in einer Vielzahl von Größen angegeben. Für meteorologische Zwecke in Bezug auf die feuchte Luft wird oft die relative Luftfeuchte φ verwendet. Diese kann man unter anderem mit einem Haarhygrometer messen. In der Technik wird in der Regel die absolute Feuchte x verwendet. Diese misst man mit einem LiCl-Geber oder Coulometrischem Feuchtesensor, bei welchen (ausgehend von stark hygroskopischem Diphosphorpentoxid) auf den Wasserdampfgehalt der Luft geschlossen wird. Eine weitere Möglichkeit zur Bestimmung des Wasserdampfgehaltes der Luft ist die Messung ihrer Temperatur an je einem trockenen und angefeuchteten Thermometer, wobei die Messstelle des zweiten Thermometers mit einem wassergetränkten Gewebe umwickelt und zur Förderung der Verdunstung mit einem kleinen Lüfter angeblasen wird. Mithilfe der beiden abgelesenen Werte lässt sich aus dem Mollier-h-x-Diagramm sofort die zugehörige Luftfeuchtigkeit ablesen. Das Psychrometer ist das praktische Ergebnis der Weiterentwicklung dieser Messmethode. In Dampferzeugern dienen neben Thermometer auch Manometer zur einfachen Messung der Dampfparameter. Wasserdampf in der GeschichteDie Erscheinung des Wasserdampfes ist den Menschen seit der Nutzbarmachung des Feuers bekannt; er entstand mehr oder weniger unbeabsichtigt beim Kochen oder beim Löschen der Feuerstelle mit Wasser. Erste Überlegungen zur technischen Nutzung von Wasserdampf werden Archimedes zugeschrieben, der eine Dampfkanone konstruierte. Leonardo da Vinci stellte zu diesem Thema erste Berechnungen an, wonach eine 8 kg schwere Kugel aus einer solchen Kanone verschossen etwa 1.250 m weit fliegen würde. Heron von Alexandria erfand den Heronsball, eine erste Dampfturbine. Seine Erfindung hatte in der Antike keinen praktischen Nutzwert, sie zeigte aber die technischen Möglichkeiten der Nutzung von Wasserdampf auf. Auf Denis Papin geht die praktische Ausführung des Schnellkochtopfes zurück. Dieser erste Druckbehälter wurde von Anfang an mit einem Sicherheitsventil ausgerüstet, nachdem es mit einem Prototyp bei den ersten Versuchen zu einem Zerknall kam. Die Erfindung und Nutzung der Dampfmaschine machten es notwendig, das Arbeitsmittel Wasserdampf theoretisch und praktisch zu untersuchen. Zu den Praktikern gehören James Watt und Carl Gustav Patrik de Laval, die durch die Vermarktung ihrer Maschinen zu wohlhabenden Männern wurden. Zu den Theoretikern gehörte dagegen Nicolas Léonard Sadi Carnot, der sich vom Wasserdampf und der Dampfmaschine zu seinen Überlegungen inspirieren ließ. In die Reihe der Forscher, die sich eingehend mit den Eigenschaften von Wasserdampf beschäftigten, gehören auch Rudolf Julius Emanuel Clausius und Ludwig Boltzmann. Nutzung in der TechnikWasserdampf wird in der Technik in Dampfkesseln erzeugt und beispielsweise zu folgenden Zwecken verwendet:
Die derzeit größten Kraftwerk-Dampferzeuger haben eine Leistung von bis zu 3.600 Tonnen Dampf pro Stunde. Derartige Mengen werden beispielsweise mit einem Wasserrohrkessel bereitgestellt. Beim technischen Einsatz von Wasserdampf ist zu beachten, dass Nassdampf im Unterschied zu den meisten anderen Flüssigkeiten und Gasen nicht gepumpt werden kann. Die beim Verdichten des Dampfes auftretenden Wasserschläge würden die Fördermaschine innerhalb kürzester Zeit zerstören. Weitere Anwendungen
In der Medizin und Therapeutik wird Wasserdampf für die Wärmeübertragung und als Träger therapeutischer Stoffe verwendet:
Gefahren durch WasserdampfGeringe Mengen Wasserdampf können große Mengen Wärme und damit Energie transportieren. Aus diesem Grund ist das zerstörerische Potenzial von dampfführenden Apparaturen wie Dampferzeuger und Rohrleitungen erheblich. Kesselzerknalle von Dampfkesseln gehörten zu schwersten Unfällen in der Technikgeschichte, derartige Ereignisse haben in der Vergangenheit mit einem Schlag ganze Industriebetriebe ausgelöscht. Der mit hoher Temperatur und hohem Druck aus einem defekten Dampfkessel frei austretende Wasserdampf ist unsichtbar, solange der Dampf überhitzt ist. Der austretende Dampf kann einen Strahl von erheblicher Länge bilden. Betrachtet man das oben aufgeführte h-s-Diagramm, bedeutet die Freisetzung von Sattdampf zuerst eine adiabate Zustandsänderung, bei der der Druck reduziert wird. Den Ausgangspunkt bildet die Sattdampfkurve rechts vom kritischen Punkt (= Sattdampfzustand im Kessel). Die Druckreduzierung verläuft parallel zur x-Achse (die Enthalpie bleibt gleich). Der austretende Freistrahl vermischt sich mit der Umgebungsluft und kühlt ab. Bei Unterschreitung von 100°C (= Sattdampftemperatur bei Umgebungsdruck) beginnt der Dampf zu kondensieren und sichtbar zu werden. Eine Gefahr bei großen Dampfaustritten ist die Nebelbildung, so dass die Orientierung im Raum für Flüchtende stark eingeschränkt ist. Weiterhin kann ausströmender überhitzer Wasserdampf sogar Brände auslösen. Hinzu kommt ein Nachverdampfen des noch flüssigen Wassers durch die eintretende Druckverringerung in der Umgebung der defekten Stelle. Ein großflächiger Kontakt mit diesem Strahl ist wegen der augenblicklich eintretenden Verbrühungen tödlich. In der letzten Zeit sind im Zusammenhang mit Wasserdampf weniger Unfälle geschehen, weil sich der Stand der Technik auf diesem Gebiet permanent zu größeren Sicherheiten hin entwickelt hat. Aufgrund des großen Volumenunterschiedes zwischen Wasser und Wasserdampf (1:1.700) ist es gefährlich, bestimmte Brände mit Wasser zu löschen. Bei einem Kaminbrand kann das Löschwasser zu einem Zerreißen des Kamins führen und somit die Löschkräfte gefährden und großen Sachschaden anrichten. Auch ein Fettbrand darf nicht mit Wasser gelöscht werden, da dieses unter das brennende Fett sinkt, dort verdampft und sich dann ausdehnt und brennendes Fett mit hochreißt, es kommt zur Fettexplosion. Begriffe und Stoffwerte
Siehe auch
Literatur
Kategorien: Wasser | Thermodynamik | Gas |
||
| Dieser Artikel basiert auf dem Artikel Wasserdampf aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





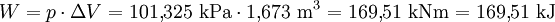
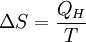
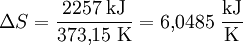
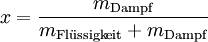
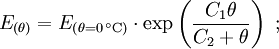
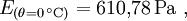
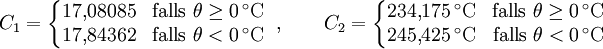
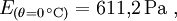

![{\theta} = \sqrt[4]{p} \cdot 100](images/math/6/9/8/698c6c0bc3f394cafe951183f37db6d2.png) ,
,


