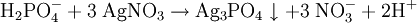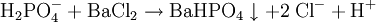Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Kaliumdihydrogenphosphat
Kaliumdihydrogenphosphat ist ein farb- und geruchloses Kaliumsalz der Phosphorsäure. Es ist zusammengesetzt aus einem Kalium-Kation (K+) und einem Dihydrogenphosphat-Anion (H2PO4-). Es gehört damit zu den Dihydrogenphosphaten. Produkt-Highlight
EigenschaftenChemische EigenschaftenKaliumdihydrogenphosphat reagiert in Wasser sauer: pH 4,4 bei einer 5%igen Lösung. Wasserfreies Kaliumdihydrogenphosphat ist hygroskopisch. VerwendungKaliumdihydrogenphosphat findet, vor allem in der Biochemie und verwandten Naturwissenschaften, Verwendung zur Herstellung von Pufferlösungen. Oft wird es dabei gemeinsam mit Dikaliumhydrogenphosphat eingesetzt, welches im Gegensatz zu Kaliumdihydrogenphosphat neutral reagiert. Das zugehörige basische Phosphat ist Kaliumphosphat. Durch Kombinationen der drei Salze gelangt man zu wässrigen Phosphatlösungen mit definiertem pH-Wert. Die Kaliumhydrogenphosphate können durch die entsprechenden Natriumhydrogenphosphate substituiert werden, falls Kaliumionen nicht erwünscht sind.
Weiterhin wird Kaliumdihydrogenphosphat als Düngemittel und als Lebensmittelzusatzstoff (E 340) eingesetzt. Es dient dabei als Säureregulator. Unter die Bezeichnung E 340 fallen jedoch auch das sekundäre Dikaliumphosphat (K2HPO4) und tertiäre Kaliumphosphat (K3PO4). Biologische BedeutungDa es eine Quelle für Phosphor darstellt, kann Kaliumdihydrogenphosphat in entsprechender Konzentration zur Eutrophierung von Gewässern beitragen. SicherheitshinweiseUnter Einwirkung von Hitze, beispielsweise bei einem Brand, kann es zum Zerfall von Kaliumdihydrogenphosphat kommen. Dabei können unter anderem Phosphoroxide freigesetzt werden. Die LD50 bei Ratten beträgt bei oraler Applikation 4640 mg/kg, bei Kaninchen (dermal) liegt sie bei mehr als 4600 mg/kg. Die Toxizität von Kaliumdihydrogenphosphat ist noch nicht vollständig geklärt. NachweisKalium-KationKaliumdihydrogenphosphat lässt sich wie andere Kaliumsalze über die violette Flammenfärbung nachweisen. Sehr spezifisch, wenn auch nicht sehr empfindlich lässt sich Kalium mit Perchlorsäure nachweisen. Dabei fällt schwerlösliches Kaliumperchlorat aus. Da Perchlorsäure und ihre Salze hochreaktiv sind, ist größte Vorsicht geboten und es empfiehlt sich, den Nachweis in sehr kleinem Maßstab durchzuführen. Dihydrogenphosphat-AnionGibt man Ammoniummolybdatlösung zu einer salpetersauren, phosphathaltigen Lösung, so fällt gelbes Ammoniummolybdophosphat aus. Arsensäure wirkt bei diesem Nachweis störend, da sie teilweise, analog zum Phosphat, als Molybdoarsenat ausgefällt wird. Wird die Lösung zunächst neutralisiert, ergeben sich weitere Möglichkeiten für Nachweise: Mit Silbernitrat bildet sich ein gelber Niederschlag von Silberphosphat, der sich in schwachen Säuren löst. Bei Zugabe von Bariumchlorid fällt weißes Bariumhydrogenphosphat aus, das sich leicht in Essigsäure löst. Literatur
Quellen
Weblink318 Kilogramm-Kristalle aus Kaliumdihydrogenphosphat und ihre Verwendung Kategorien: Kaliumverbindung | Phosphat |
|||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Kaliumdihydrogenphosphat aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||





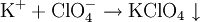
![\mathrm{H_2PO_4^- + 22 \; H^+ + 3 \; NH_4^+ + 12 \; MoO_4^{2-} \rightarrow (NH_4)_3[P(Mo_3O_{10})_4 \cdot aq]\downarrow + 12 \; H_2O}](images/math/c/8/b/c8bff1112037fe8babe588136d862de5.png)