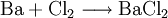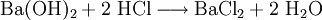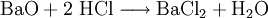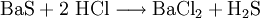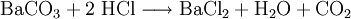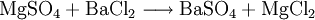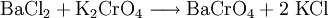Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Bariumchlorid
Bariumchlorid, unter Normalbedingungen ein weißes, kristallines Pulver, ist eine anorganische chemische Verbindung. Häufig kommt Bariumchlorid in Verbindung mit zwei Wassermolekülen vor. Obwohl Bariumchlorid giftig ist, wird es vielfach eingesetzt. Produkt-Highlight
Eigenschaften des BariumchloridsBariumchlorid weist wie Barium und alle seine Salze eine grüne Flammenfärbung auf, ist gut in Wasser löslich und wie alle löslichen Bariumverbindungen giftig. ToxizitätBariumchlorid ist schwach wassergefährdend. Ab 2-4 g kann Bariumchlorid tödlich wirken. Bariumchlorid ist giftig beim Einatmen und Verschlucken. Bei Unfall oder Unwohlsein auf Grund dieses Stoffes sofort Arzt zuziehen. Als Erste-Hilfe-Maßnahme ist die Einnahme von Natrium- bzw. Kaliumsulfatlösung zu empfehlen, da Sulfationen die Bariumionen ausfällen und dabei unlösliches und somit ungiftiges Bariumsulfat bilden. Bariumchlorid ist unter Verschluss und für Kinder unzugänglich aufzubewahren. Synthese des BariumchloridsBariumchlorid lässt sich wie alle Salzbildungsreaktionen darstellen:
Großtechnische Synthese des BariumchloridsKommerziell wird Bariumchlorid durch Reaktion von Bariumsulfid mit Salzsäure unter Bildung von Schwefelwasserstoffsäure synthetisiert: Auch durch Reaktion von Bariumcarbonat mit Salzsäure entsteht Bariumchlorid bei gleichzeitiger Bildung von Wasser und Kohlenstoffdioxid: Reaktionen des BariumchloridsReaktion mit Sulfat-Ionen:
Reaktion mit Kaliumchromat:
Verwendung des BariumchloridsBariumchlorid wird als Indikator für Sulfat-Ionen angewendet, da bei der Reaktion mit Sulfat-Ionen (siehe Reaktionen) Bariumsulfat als weißer Feststoff ausfällt. Diese Fällungsreaktion kann auch zur Reinigung von Natriumchlorid von Sulfaten eingesetzt werden. Außerdem wird Bariumchlorid zum Härten von Stahl, in der Pyrotechnik aufgrund seiner grünen Flammenfärbung und zur Herstellung der Farbstoffe Bariumsulfat (siehe Reaktionen) und Bariumchromat (siehe Reaktionen) benutzt. Die Rote Armee benutzte während des Zweiten Weltkriegs grünlich leuchtende Bariumchlorid-Leuchtspurgeschosse, um dem Schützen das Zielen zu erleichtern, während die Deutsche Wehrmacht gelblich leuchtende Phosphor-Geschosse verwendete. Diese Geschosse wurden in den LMGs und MGs der Panzer eingesetzt. Auch halfen diese Geschosse anderen Soldaten, da sie sahen, wohin der Schütze zielte. Formen des BariumchloridsBariumchlorid kommt meist in Verbindung mit zwei Molekülen Kristallwasser, als Bariumchloriddihyrat vor. Wasserfreies Bariumchlorid erhält man, wenn man Bariumchloriddihydrat das Wasser durch Wärme entzieht (Dehydratation). Eigenschaften des BariumchloriddihydratesAuch Bariumchloriddihydrat ist ein weißes, kristallines Pulver. Unterschiede zum Bariumchlorid ergeben sie bei der Molmasse, Dichte, Löslichkeit, Schmelz- und Siedepunkt
Quellen
Kategorien: Giftiger Stoff | Chlorid | Bariumverbindung |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Bariumchlorid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||