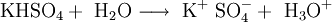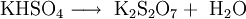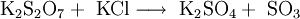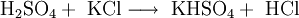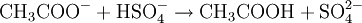Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Kaliumhydrogensulfat
Kaliumhydrogensulfat KHSO4 ist ein saures Kaliumsalz der Schwefelsäure. Es entsteht, wenn Schwefelsäure nur zu 50% mit Kalilauge neutralisiert und die Lösung eingedampft wird. Das Produkt ist ätzend, kristallin und enthält neben Kaliumionen das Hydrogensulfat-Anion HSO4- Produkt-HighlightDer weiße, kristalline Feststoff löst sich leicht unter Bildung einer sauren Lösung in Wasser:
Erhitzt man das schwefelsaure Kaliumsulfat, so wandelt es sich unter Abgabe von Wasser (Dehydratisierung) in Kaliumdisulfat um:
Bei weiterem Erhitzen zerfällt das Kaliumdisulfat in Kaliumsulfat und Schwefeltrioxid:
Die Synthese von Kalium- und Natriumhydrogensulfat gelingt durch Einwirkung mäßig warmer, konzentrierter Schwefelsäure auf Kalium- bzw. Natriumchlorid. Als Nebenprodukt dieser Verdrängungsreaktion entsteht das Gas Chlorwasserstoff:
Kaliumhydrogensulfat dient ebenso wie preiswertere Natriumhydrogensulfat als saurer Abflussreiniger (Auflösen von Kalk durch Verdrängungsreaktion) sowie als Nachweisreagenz für Acetate. Acetat-Ionen (H3CCOO-) lassen sich mit Kaliumhydrogensulfat nachweisen, indem man das Salz, von dem man annimmt, dass es ein Acetat ist, mit Kaliumhydrogensulfat im Mörser zerreibt. Dabei wird das Proton (H+) des Hydrogensulfat-Ions auf das Acetation übertragen. Dabei entsteht Essigsäure, die leicht an ihrem typischen Geruch identifiziert werden kann.
Quellen
Kategorien: Ätzender Stoff | Kaliumverbindung | Sulfat |
||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Kaliumhydrogensulfat aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||