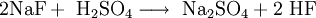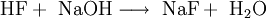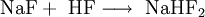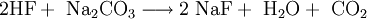Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Natriumfluorid
Natriumfluorid ist ein Natriumsalz der Fluorwasserstoffsäure. Produkt-Highlight
EigenschaftenDas farblose Natriumfluorid kristallisiert in der Natriumchloridstruktur und lässt sich zu Einkristallen "züchten". Es ist durchlässig für Infrarot- und UV-Licht. In Wasser ist es bei allen Temperaturen nur mäßig löslich. Erwärmen steigert die Löslichkeit kaum. In Ethanol löst es sich nicht. In konzentrierter Schwefelsäure setzt es sich zu Natriumsulfat und Fluorwasserstoff um. Infolge teilweiser Hydrolyse reagiert die wässrige Lösung von Natriumfluorid leicht alkalisch. Natriumfluorid wirkt als Insektizid und ist giftig. Natriumfluorid bildet mit Natriumchlorid, Natriumcarbonat und Calciumfluorid Schmelzen mit einem Eutektikum, mit Natriumsulfat Schmelzen mit zwei Eutektika. Flüssiges Natriumfluorid leitet den elektrischen Strom, wobei der Widerstand mit steigender Temperatur abnimmt. ReaktionsverhaltenNatriumfluorid und Schwefelsäure reagieren zu Natriumsulfat und Fluorwasserstoff. Die hohe Toxizität von NaF im Vergleich zu anderen Natriumhalogeniden (z.B. Natriumchlorid) ist in der Wirkung des Fluoridanions als starke Lewis-Base begründet. Das Fluorid bindet an alle eisenhaltigen Enzyme und blockiert sie somit. DarstellungNeutralisation von konzentrierter Fluorwasserstoffsäure mit Natronlauge Überschüssiger Fluorwasserstoff führt zur Bildung von Natriumhydrogenfluorid: Umsetzung von Fluorwasserstoffsäure mit Natriumcarbonat: Ausgehend vom Natriumsalz der Hexafluorokieselsäure kann Natriumfluorid durch thermische Zersetzung gewonnen werden. VerwendungNatriumfluorid wird als Holzschutzmittel und zum Konservieren von Klebstoffen verwendet. Bei der elektrolytischen Gewinnung von Aluminium dient es als Flussmittel, in der Metallurgie als Schlackenzusatz für Metallschmelzen.
VorsichtsmaßnahmenNatriumfluorid ist giftig. Das Einatmen von Stäuben ist zu vermeiden. Bei der Arbeit mit Natriumfluorid sind Handschuhe zu tragen. Als letal wird eine Menge von 15 mg/kg Körpergewicht angesehen.[1] Referenzen
Kategorien: Giftiger Stoff | Natriumverbindung | Fluorid | Arzneistoff |
||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Natriumfluorid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||||||