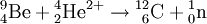Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Neutron
Das Neutron [ˈnɔɪ̯trɔn] (Plural Neutronen [nɔɪ̯ˈtroːnən]) ist ein elektrisch neutrales Hadron mit dem Formelzeichen n. Es ist Bestandteil der Atomkerne und gehört wie das Proton zu den Nukleonen. Es kommt auch als freies Neutron vor; in diesem Zustand ist es nicht stabil, hat aber im Vergleich zu allen anderen nicht stabilen Elementarteilchen die längste Lebensdauer. Produkt-HighlightPhysikalische BeschreibungDas Neutron hat den Spin 1/2 und ist damit ein Fermion. Außerdem gehört es zu den Baryonen. Neutronen bestehen ihrerseits aus zwei d-Quarks und einem u-Quark (Formel udd). Wie seine Bestandteile unterliegt auch das Neutron sowohl der starken als auch der schwachen Wechselwirkung. Freie Neutronen haben lediglich eine mittlere Lebensdauer von knapp 15 Minuten. Bemerkenswert ist, dass das Neutron – obwohl es ein elektrisch neutrales Teilchen ist – ein magnetisches Moment hat und damit auch der elektromagnetischen Wechselwirkung unterliegt. Die Erklärung dieses magnetischen Moments ist ein sehr schwieriges Problem der theoretischen Physik. Die Ruhemasse des (freien) Neutrons ist um etwa 0,14 % (1,293 MeV) größer als die des (freien) Protons. Der Durchmesser des Neutrons beträgt etwa 1,5 · 10-15 m, ist jedoch nicht klar definiert. Neutronen als Bestandteile von AtomkernenMit Ausnahme des häufigsten Wasserstoffisotops (Protium, 1H), dessen Atomkern nur aus einem einzelnen Proton besteht und das den normalen Wasserstoff bildet, enthalten alle anderen Atomkerne sowohl Protonen als auch Neutronen. Die Anzahl der Protonen im Kern und die damit identische Anzahl der Elektronen bestimmt, um welches chemische Element es sich handelt, da die chemischen Eigenschaften aus dem Aufbau der Elektronenhülle resultieren. Neutronen und Protonen haben fast das gleiche Gewicht. Im Atomkern zusätzlich vorhandene Neutronen tragen somit zur atomaren Gesamtmasse bei. Ihre Anzahl im Kern bestimmt, um welches Isotop des Elements es sich handelt. Jedes Isotop wird durch die Summe der Anzahl Protonen und Neutronen charakterisiert, die entweder als Hochzahl vor oder mit einem Bindestrich hinter das Elementsymbol geschrieben wird; Beispiele: 60Co oder Co-60, 235U oder U-235. Um daraus die Neutronenanzahl zu ermitteln, muss die Ordnungszahl (Protonenanzahl) des Elements bekannt sein: Die OZ für Uran ist 92: 235 Nukleonen minus 92 Protonen ergibt 143 Neutronen. Isotope eines Elements unterscheiden sich nicht darin, welche chemischen Verbindungen gebildet werden können. Zusätzliche Neutronen im Kern bewirken aber aufgrund des höheren Gewichts ein etwas trägeres chemisches Reaktionsverhalten und voneinander abweichende physikalische Eigenschaften. Am deutlichsten sind diese Unterschiede zwischen Wasserstoff (1H) und dem doppelt so schweren Deuterium (2H) sowie dem dreifach so schwerem Tritium (3H), siehe Isotopeneffekt. In einem Atomkern können nicht beliebig viele Neutronen sein. Für jede Anzahl von Protonen zwischen 1 und 82 (ausgenommen 43 Technetium) gibt es bestimmte Anzahlen von Neutronen, die zusammen mit diesen Protonen stabile Kerne bilden. Mit mehr oder weniger Neutronen sind die Kerne instabil, sie zerfallen in unterschiedlichen Zeiten radioaktiv. Stabile Kerne werden bis etwa zum Calcium aus gleichvielen Protonen und Neutronen gebildet (je 40), darüber wächst der Neutronenanteil kontinuierlich auf fast das Anderthalbfache an (siehe Isotopentabelle). Ab 83 Protonen (Bismut) existieren keine stabilen Atomkerne: Es gibt keine Neutronenzahl, die damit stabile Kerne zu bilden vermag. Schwache WechselwirkungNeutronen unterliegen der schwachen Wechselwirkung. Der hierdurch verursachte Betazerfall bewirkt die Umwandlung eines Neutrons in ein Proton, ein Elektron und ein Antineutrino: Der Beta-Zerfall betrifft sowohl freie als auch in manchen Atomkernen gebundene Neutronen; die angegebene Exzessenergie von 0,78 MeV gilt für den Zerfall des freien Neutrons. Der umgekehrte Prozess tritt z. B. bei der Entstehung eines Neutronensternes auf und ist auch unter Normalbedingungen theoretisch möglich, aber statistisch extrem selten, da drei Teilchen mit einer genau abgestimmten Energie gleichzeitig zusammenstoßen müssen: Lebensdauer freier NeutronenDie Lebensdauer des freien Neutrons beträgt etwa Die genaue Kenntnis der Lebensdauer des freien Neutrons ist vor allem für die Kosmologie wichtig. In einer frühen Phase des Universums machten freie Neutronen einen bedeutenden Teil der Materie aus. So könnte man die Entstehung besonders der leichten Elemente (und deren Isotopenverteilung) besser nachvollziehen, wenn die Lebensdauer des Neutrons genau bekannt wäre. Außerdem erhofft man sich ein besseres Verständnis der schwachen Wechselwirkung. Eine Gruppe am Hahn-Meitner-Institut (HMI) in Berlin arbeitet daran, die Zerfallszeit des freien Neutrons präziser zu messen. Dabei werden Neutronen in einer dreidimensionalen magnetischen Falle eingeschlossen. Die Wechselwirkung des Neutrons mit den Magnetkräften des Käfigs erfolgt über das schwache magnetische Dipolmoment des Neutrons. Dies bedingt eine besonders ausgefeilte Gestaltung des Feldes im Käfig. Die Neutronen, die aus einem Forschungsreaktor in die Falle gelangen, werden von suprafluidem Helium in der Kammer abgebremst und eingefangen. Das aus dem Zerfall stammende hochenergetische Elektron dient als Nachweis. Es ionisiert auf seiner Flugbahn mehrere Helium-Atome, die über Molekülprozesse (Excimere) ein messbares Lichtsignal aussenden. Neutronen selbst hinterlassen in einer Blasenkammer keine Spur, weil sie nicht mit Atomelektronen wechselwirken, also nicht ionisieren. Starke und elektromagnetische WechselwirkungNeutronen unterliegen der starken Wechselwirkung, nicht aber der elektrostatischen Abstoßung. Die starke Wechselwirkung zwischen Protonen und Neutronen ist für den Erhalt und die Stabilität des Atomkernes verantwortlich. Während die positiv geladenen Protonen untereinander sowohl anziehende (starke Wechselwirkung) als auch abstoßende Kräfte (elektromagnetische Wechselwirkung) erfahren, tritt zwischen Neutronen untereinander und zwischen Neutronen und Protonen keine elektrostatische Abstoßung auf. Die starke Wechselwirkung bestimmt auch das Verhalten von freien Neutronen bei Stößen mit Atomkernen. Die elektromagnetische Wechselwirkung ist zwar schwächer als die starke Wechselwirkung, wirkt aber im Gegensatz zu dieser auch über größere Entfernungen, da sie (nur) umgekehrt proportional zum Quadrat der Entfernung abnimmt. Die starke Wechselwirkung – die man auch als eine Äußerungsform der zwischen den Quarks der Nukleonen wirkenden Farbkraft interpretieren kann – wirkt dagegen nur auf sehr kurze Distanz (Größenordnung 1 fm) und strebt mit größerer Entfernung schnell gegen Null. Voraussetzung für die Stabilität eines Atomkerns ist, dass die Bindungsenergie aufgrund der starken Wechselwirkung höher ist als die potentielle Energie aufgrund der elektrostatischen Abstoßung. Obwohl sie sich durch statische elektrische Felder nicht ablenken lassen, unterliegen Neutronen doch auch der elektromagnetischen Wechselwirkung, da sie über einen Spin und somit über ein magnetisches Moment verfügen. Typische Kernreaktionen mit NeutronenFreie (also nicht in einem Kern gebundene) Neutronen können an Atomkernen gestreut werden, von ihnen absorbiert werden oder Kernreaktionen auslösen. Die Streuung kann elastisch oder inelastisch sein. Bei inelastischer Streuung verbleibt der Atomkern in einem angeregten Zustand, der dann (meist) durch Emission von Gammastrahlung zum Grundzustand zurückkehrt. Insbesondere thermische, d. h. langsame Neutronen werden von vielen Atomkernen absorbiert. Auch dabei wird ein Gammaquant emittiert. Der dabei entstehende neue Atomkern, ein anderes Isotop des ursprünglichen Kerns, kann radioaktiv sein. Einige wenige Nuklide spalten sich nach dem Einfangen eines Neutrons. In Kernreaktoren wird dieser Prozess als Kettenreaktion zur Energiegewinnung genutzt. Schnelle freie Neutronen (s. unten) lösen Kernreaktionen z. B. des Typs (n,p) oder (n,alpha) aus, wodurch ebenfalls in vielen Fällen ein Radionuklid-Kern entsteht. Wirkungen von Neutronenbestrahlung auf Materie(siehe auch Strahlenschaden) Die Materialeigenschaften von Metallen und anderen Werkstoffen werden durch Neutronenbestrahlung verschlechtert. Dies begrenzt die Lebensdauer von Komponenten in z. B. Kernreaktoren. In Kernfusionsreaktoren mit ihrer höheren Energie der Neutronen tritt dieses Problem verstärkt auf. Die Wirkung auf lebende Materie ist ebenfalls meist schädlich. Sie beruht bei schnellen Neutronen größtenteils auf von diesen angestoßenen Protonen, die einer stark ionisierenden Strahlung entsprechen. Die Nutzung von schnellen Neutronen in der Strahlentherapie beschränkt sich auf wenige Sonderfälle. Thermische Neutronen erzeugen durch die Einfang-Kernreaktion 1H(n, gamma) 2H an Wasserstoff eine Gammastrahlung, die ihrerseits ionisiert. Geschichte der Entdeckung und ErforschungDie ersten Schritte zur Entdeckung des Neutrons wurden von Walther Bothe und seinem Studenten Herbert Becker getan. Sie beschrieben im Jahr 1930 einen ungewöhnlichen Typ von Strahlung, der entstand, wenn sie Beryllium mit Polonium-Alphateilchen beschossen. Ziel der Versuche war es, eine Theorie Ernest Rutherfords zu bestätigen, wonach bei diesem Vorgang sehr energiereiche Strahlung emittiert werden sollte. Dementsprechend hielten sie die durchdringende Strahlung, die sie bei diesen Versuchen mit Hilfe von elektrischen Zählmethoden feststellen konnten, anfänglich fälschlicherweise für Gammastrahlung. Die gleichen Versuche machten sie auch mit Lithium und Bor, und kamen schlussendlich zum Ergebnis, dass die beobachteten „Gammastrahlen“ mehr Energie besaßen als die Alphateilchen, mit denen sie die Atome beschossen hatten. Bei der Bestrahlung von Beryllium mit Alphateilchen entstand nicht – wie zuvor erwartet – Bor, sondern Kohlenstoff. In heutiger Schreibweise lautet die beobachtete Kernreaktion: Die beobachtete, sehr energiereiche Strahlung hatte ein großes Durchdringungsvermögen durch Materie, zeigte jedoch sonst ein für Gammastrahlung sehr ungewöhnliches Verhalten. Die Strahlen waren zum Beispiel in der Lage, leichte Atome in schnelle Bewegung zu versetzen. Eine genauere Analyse zeigte, dass die Energie dieser „Gammastrahlung“ so groß hätte sein müssen, dass sie alles bis dahin Bekannte weit übertroffen hätte. So kamen mehr und mehr Zweifel auf, ob es sich bei der beobachteten Strahlung wirklich um Gammastrahlen handelte. Entsprechend dem durchgeführten Versuch nannte man die Strahlung inzwischen „Beryllium-Strahlung“. Ein Jahr später, 1931, stellten Irène Joliot-Curie und ihr Ehemann Frédéric Joliot-Curie bei Experimenten mit der Beryllium-Strahlung folgende Tatsache fest: Lässt man die „Beryllium-Strahlung“ in eine Ionisationskammer treffen, so zeigt diese keinen nennenswerten Strom an. Bringt man jedoch vor die Ionisationskammer eine wasserstoffhaltige Materialschicht (zum Beispiel Paraffin), dann steigt der Strom in der Kammer stark an. Als Ursache für den Stromanstieg in der Ionisationskammer vermutete das Ehepaar Joliot-Curie, dass aus dem wasserstoffhaltigen Paraffin Protonen durch die „Beryllium-Strahlung“ herausgelöst werden, welche dann in der Ionisationskammer die notwendige Ionisierung bewirken. Sie konnten ihre Vermutung sogar durch den Nachweis solcher Rückstoß-Protonen in der Wilsonschen Nebelkammer belegen. Als Mechanismus vermuteten Joliot-Curie einen dem Comptoneffekt verwandten Vorgang. Die harte Gammastrahlung sollte den Protonen den notwendigen Impuls übertragen. Abschätzungen zeigten jedoch, dass zur Erzeugung eines Rückstoßprotons, dessen Spurlänge in der Nebelkammer etwa 26 cm betrug, eine Gammaenergie von etwa 50 MeV notwendig wäre, was ziemlich unrealistisch erschien. Sir James Chadwick – ein Schüler Rutherfords – glaubte wie sein Lehrmeister nicht an einen „Comptoneffekt beim Proton“ und nahm an, dass die „Beryllium-Strahlung“ aus Teilchen bestehen müsse. Als Irene und Frederic Joliot-Curie ihre Versuchsergebnisse veröffentlichten, in denen sie zeigten, dass Bothes „Beryllium-Strahlung“ in der Lage war, aus Paraffin Protonen mit hoher Energie herauszuschlagen, war für Chadwick klar, dass es sich nicht um Gammastrahlung, sondern nur um Teilchen mit einer dem Proton vergleichbaren Masse handeln konnte. In den zahlreichen Versuchen wiederholte er die Experimente des Ehepaares Joliot-Curie und bestätigte den Joliot-Curieschen Kernschleuder-Effekt. Weiterhin konnte er 1932 experimentell nachweisen, dass es sich bei Bothes „Beryllium-Strahlung“ nicht um Gammastrahlen, sondern vielmehr um einen Geschossregen aus schnell bewegten Teilchen handelte, die ungefähr die Masse des Protons besitzen, jedoch elektrisch neutral sind. Er erkannte, dass die Eigenschaften dieses Typs Strahlung eher mit denen eines bereits zwölf Jahre zuvor von Ernest Rutherford als Kernbaustein vermuteten neutralen Teilchens in Einklang zu bringen waren. Da die nunmehr entdeckten Teilchen keine elektrische Ladung trugen, nannte er sie Neutronen. Für die Entdeckung des Neutrons erhielt er 1935 den Nobelpreis für Physik. Mit dieser Entdeckung konnte die Beschreibung des Atomaufbaus vorerst vollendet werden: Der Atomkern, bestehend aus Protonen und Neutronen, wird von einer Hülle aus Elektronen umgeben. Bei einem elektrisch neutralen Atom entspricht die Anzahl der negativ geladenen Elektronen in der Atomhülle stets genau jener der positiv geladenen Protonen im Atomkern, wohingegen die Anzahl der Neutronen im Kern variieren kann. Im gleichen Jahr 1932 stellte Werner Heisenberg seine Nukleonentheorie auf. Um 1940 nahm man an, dass das Neutron eine Verbindung aus Proton und Elektron darstellt. So hätte man alle Atome auf diese zwei Bausteine zurückführen können. Erst mit der weiteren Entwicklung der Quantenmechanik und der Kernphysik wurde klar, dass es keine Elektronen als dauerhafte Bestandteile des Kerns geben kann. Erzeugung und Nachweis freier Neutronen für die MaterieforschungEs gibt viele verschiedene Arten von Neutronenquellen. In der angewandten Forschung (Untersuchung der Struktur und Dynamik von Materie durch elastische und inelastische Neutronenstreuung) werden vor allem Neutronen aus Forschungsreaktoren genutzt. Dort werden die Neutronen bei der Kernspaltung frei. Diese schnellen Neutronen haben allerdings eine Energie im Bereich von einigen MeV und müssen erst auf rund ein Millionstel ihrer Bewegungsenergie abgebremst werden, um mit ihnen kondensierte Materie untersuchen zu können. Thermische NeutronenDie Abbremsung geschieht in einem den Reaktorkern umgebenden Wassertank (leichtes oder schweres Wasser als Moderator). Bei jedem Zusammenstoß eines schnellen Neutrons mit einem Atomkern des Wassers wird Energie an den getroffenen Kern abgegeben. Nach vielen solchen Stößen weisen die Neutronen ein der Wassertemperatur (etwa 300 K, „Zimmertemperatur“) entsprechendes Energiespektrum auf. Man spricht dann von thermischen Neutronen (siehe untenstehende Tabelle). „Kalte“ und „heiße“ NeutronenDurch das Einbringen von zusätzlichen Moderatoren kann das Energiespektrum der Neutronen auch zu höheren oder niedrigeren Energien verschoben werden. Diese zusätzlichen Moderatoren bezeichnet man auch als sekundäre Neutronenquellen. Zur Gewinnung von sogenannten kalten Neutronen kommt häufig flüssiges Deuterium mit einer Temperatur von etwa 20 K zum Einsatz. Sogenannte heiße Neutronen werden in der Regel mit Graphit-Moderatoren bei etwa 3000 K erzeugt. In jedem Fall werden die Neutronen durch sogenannte Strahlrohre aus dem Moderatortank oder den sekundären Neutronenquellen zu den Experimenten geleitet. Allerdings müssen noch genügend viele Neutronen im Reaktorkern verbleiben oder dorthin zurück reflektiert werden, um die Kettenreaktion aufrecht zu erhalten. Kalte, thermische und heiße Neutronen weisen jeweils eine bestimmte Energieverteilung und damit Wellenlängenverteilung auf. Für viele Experimente werden jedoch monochromatische oder monoenergetische Neutronen, also Neutronen einheitlicher Energie, benötigt. Diese erhält man z. B. durch den Einsatz eines Monochromators. Als Monochromatoren kommen perfekte Einkristalle oder Mosaik-Kristalle zum Einsatz (Silizium, Germanium, Kupfer, Graphit etc.), wobei durch die Auswahl bestimmter Bragg-Reflexe und Monochromatorwinkel verschiedene Wellenlängen (Energien) aus der Wellenlängenverteilung extrahiert werden können. Da Neutronen keine elektrische Ladung tragen, können sie nicht direkt mit den auf Ionisierung beruhenden Detektoren nachgewiesen werden. Der Nachweis von Neutronen geschieht mittels Neutronendetektoren. Bei niederen Neutronenenergien (unter etwa 100 keV) beruhen diese stets auf einer geeigneten Kernreaktion. KlassifizierungDer Wirkungsquerschnitt von Reaktionen zwischen Neutronen und anderen Teilchen variiert stark mit der kinetischen Energie der Neutronen. Folgende Klassifikation hat sich herausgebildet:
Literatur
Kategorien: Elementarteilchen | Nuklid | Kernphysik |
||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Neutron aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||||||||





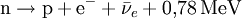
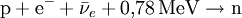
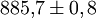 Sekunden (knapp 15 Minuten). Genauer ist sie nicht bekannt, weil die Messung sehr schwierig ist: Freie Neutronen lassen sich zwar mit
Sekunden (knapp 15 Minuten). Genauer ist sie nicht bekannt, weil die Messung sehr schwierig ist: Freie Neutronen lassen sich zwar mit