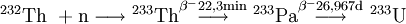Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Uran
Uran ist ein chemisches Element mit dem Symbol U und der Ordnungszahl 92. Es gehört zu den Actinoiden. Weil Uranisotope mit ungerader Neutronenzahl durch thermische Neutronen relativ gut spaltbar sind, ist das Uranisotop 235U die einzige bekannte natürlich vorkommende Substanz, die zu einer nuklearen Kettenreaktion fähig ist. Uran 235U wird in Kernkraftwerken und Kernwaffen als Primärenergieträger genutzt. Seine wirtschaftliche Bedeutung ist groß. Aber auch das aus Thorium 232Th erbrütete künstliche Uran 233U ist spaltbar und wird in Hochtemperaturreaktoren erzeugt und verbraucht. Produkt-Highlight
GeschichteUran wurde 1789 von dem deutschen, damals in Berlin lebenden Chemieprofessor und Apotheker Martin Heinrich Klaproth (1743–1817) aus dem Mineral Pechblende isoliert. Es ist nach dem Planeten Uranus benannt, der acht Jahre zuvor (1781) von Friedrich Wilhelm Herschel (1738–1822) entdeckt worden war. Am 24. September 1789 gab Klaproth die Entdeckung in einer Ansprache vor der Preußischen Akademie der Wissenschaften bekannt. Zuerst wurde seine Entdeckung Uranit genannt, 1790 dann in Uranium umbenannt. Klaproth hatte seine Entdeckung beim Analysieren des Erzes aus dem Bergwerk „Georg Wagsfort“ in Wittigstal bei Johanngeorgenstadt in Sachsen gemacht. Er behandelte das Erz mit Säure und erwärmte es stark. Das Ergebnis bestand in einem schwarzen Pulver, das er Uran nannte. Klaproth hatte tatsächlich ein neues Element identifiziert, aber was er gewonnen hatte, war nicht das Element Uran selbst, sondern ein Oxid. Erst fünfzig Jahre später im Jahre 1841 gelang es dem Franzosen Eugène Peligot, reines Uranmetall zu gewinnen. In der ersten Hälfte des 19. Jahrhunderts wurde Uran zusammen mit anderen Mineralien in St. Joachimsthal sowie in einigen Minen in Cornwall (England) gewonnen. Abgesehen vom Wert, den es für Chemiker hatte, wurde Uran im ganzen 19. Jahrhundert zum Färben von Glas und Keramik verwendet. Uranverbindungen wurden in der Glasherstellung eingesetzt, um Vasen und Dekorationsstücken, aber auch alltäglichen Gebrauchsgegenständen wie Schüsseln, Gläsern etc. eine gelbgrüne Farbe (annagrün) zu geben. Glashersteller aus Joachimsthal (Böhmen) benutzten diese Technik bereits 1826. Die Verwendung von Uran zur Glasfärbung wurde bis in die Mitte des 20. Jahrhunderts fortgeführt, erst dann wurde es durch andere, weniger bedenkliche farbgebende Mineralien ersetzt. Keramische Glasuren von Orange bis leuchtend Rot wurden für Geschirr bis hin zu architektonischem Beiwerk verwendet. In der Photographie wurde bis weit ins 20. Jahrhundert Uranylnitrat zur Braun- und Rottonung von Diapositivplatten, Platinbildern, und Bromsilberbildern verwendet. [1] Die gesundheitlichen Risiken durch die Verwendung bzw. das Sammeln von Uranglas und Keramiken mit Uranglasur sind bis heute Streitpunkt von Sammlern und Wissenschaftlern. Dass Uran radioaktiv ist, wurde 1896 zuerst von Henri Becquerel festgestellt. Uran galt lange als das Element mit der höchsten Ordnungszahl, das natürlich vorkommt. Im Jahr 1971 wurden jedoch winzigste Spuren des Plutoniumisotops 244Pu nachgewiesen, so dass Plutonium Uran als letztes bekanntes natürliches Element ablöste. VorkommenUran kommt in der Natur nicht als reines Metall vor, sondern in Form von über 200 Uranmineralien. Uraninit (Pechblende, UO2) und Coffinit (USiO4) sind die wichtigsten Lagerstätten bildenden Minerale. In der Erdkruste ist Uran mit einem Vorkommen von 4 mg/kg relativ häufig vertreten. Im normalen Boden kommt es als Spurenelement vor. Die US-amerikanische Agency for Toxic Substances and Disease Registry (ATSDR) schätzt, dass sich in den obersten 33 cm Erdboden einer Fläche von einer Quadratmeile Land im Mittel ca. 4 Tonnen Uran befinden, also etwa 1,5 Tonnen pro Quadratkilometer. In Komplexen gebundenes Uran ist auch ein ubiquitäres Element in der Hydrosphäre. Die Urankonzentration von ca. 3,3 µg/l in Meerwasser gegenüber den zum Teil deutlich geringeren Konzentrationen in den Flüssen – 0,03 µg/l im Amazonas bis 3,9 µg/l im Ganges – zeigt, dass Uran ein Element ist, das im Meer angereichert wird. Deutsche Flüsse weisen in der Regel Urankonzentrationen zwischen ca. 1 und 3 µg/l auf. Die Quelle für das Uran liegt in dem geogenen Aufbau der durch die Flüsse entwässerten Gebiete und ist somit natürlichen Ursprungs. Lediglich in Ausnahmefällen sind die Urangehalte in Flüssen auf menschlichen Einfluss bspw. die Nutzung uranhaltiger Phosphatdünger, den Uranbergbau (Zwickauer Mulde: ca. 10 µg/l) oder kerntechnische Anlagen zurückzuführen. Uran findet sich in Deutschland im unbeeinflussten Grundwasser in Konzentrationen von kleiner 1 bis über 100 µg/l. Die regelmäßige Einnahme von Trinkwasser mit erhöhten Urangehalten kann zum Auftreten von Nierenkrebs führen. Aus diesem Grund empfiehlt die Weltgesundheitsbehörde (WHO) für Trinkwasser einen Grenzwert von 15 µg/l. Die größten Uranerzreserven liegen nach Angaben der IAEA in den USA, Niger, Australien [2], Kasachstan, Namibia, Südafrika, Kanada, Brasilien, Russland, Ukraine und Usbekistan. Abbau
In Deutschland wurde Uran in der Sächsischen Schweiz (Königstein) zuerst konventionell und später durch Laugung, in Dresden (Coschütz-Gittersee) und im Erzgebirge (Schlema, Schneeberg, Johanngeorgenstadt, Pöhla) sowie in Ostthüringen (Ronneburg) meist untertage als Pechblende durch die SDAG Wismut abgebaut. Geringe Mengen wurden auch im Schwarzwald und im Fichtelgebirge gefördert. Die meisten Abbaugebiete wurden nach 1990 geschlossen, da sie unwirtschaftlich waren und auch der Bedarf an Uran zurückging. Letzteres geschah auf Grund der geänderten politischen Weltlage (geringere Bedeutung von strategischen Atomwaffen) und des niedrigen Weltmarktpreises. Die DDR war damals weltweit der drittgrößte Uranproduzent. Deutschland verfügt immer noch über mittelgroße Uranreserven, aufgrund politischer Entscheidungen, trotz des inzwischen wieder hohen Uranpreises, werden diese jedoch nicht gefördert. Die Weltproduktion von Uran betrug im Jahr 2003 41.429 Tonnen, wovon 25 % in Kanada gewonnen wurde. Weitere große Förderländer sind Australien, Russland, Niger, Namibia, Kasachstan, Usbekistan, Südafrika, und die USA. Der Uranabbau kann zu Schäden bei Mensch und Umwelt führen, da durch den Uranbergbau Uran und radioaktive Folgeprodukte (z. B. das radioaktive Edelgas Radon) freigesetzt und aus dem Untergrund an die Oberfläche geholt werden. Um weltweit akzeptierte Umweltstandards zu dokumentieren, lassen große Minengesellschaften ihre Abbau-Methoden nach ISO-Normen zertifizieren. Wirtschaftlich nutzbare Uranreserven
Die wirtschaftlich förderbaren Uranreserven (definiert durch den maximalen Förderpreis pro Kilogramm nach heutigem Stand der Technik) wurden von der Internationalen Atomenergie Organisation (IAEA) und der OECD Nuclear Energy Agency (NEA) im Jahr 2006 (letzte Veröffentlichung, Datenstand 2005) im so genannten Red Book [3] ausgewiesen. Demnach sind – je nach Höhe der unterstellten Förderkosten (Maximum bei 130$/kg) und der Sicherheit ihrer Erfassung – insgesamt noch zwischen 1,73 und 9,4 Millionen Tonnen Uran vorhanden. Bei der aktuellen Verbrauchsrate (67.320t) stehen die weltweiten Uranreserven (hinreichend gesicherte und geschätzte der Kategorie I) von 4.742.000 t noch ca. 70 Jahre [4] [5] lang zur Verfügung. Der Uranbedarf kann sich je nach Ausbau der Kapazitäten auf 100.760 t bis zum Jahr 2025 erhöhen. Das Red Book verzeichnet weiterhin noch unentdeckte vermutete Vorräte (der Kategorie II, sowie hypothetische welche sich zu einem Preis von weniger als 130$/kg fördern ließen von 10 Millionen Tonnen Uran. Wenn man diese vermuteten Uranvorkommen zum Vorrat hinzu addiert, belaufen sich die momentanen Uranvorräte auf insgesamt 14,7 Millionen Tonnen Uran. Ein weiterer Faktor ist die noch unvollständige weltweite Suche nach Uranlagerstätten, welche nach den 70er Jahren erst jetzt wieder anläuft. Allerdings wird von Wissenschaftlern bezweifelt, ob sich dieser und der vermutete Vorrat aufgrund schlechterem Erzgehalt und schwierigeren Förderbedingungen überhaupt wirtschaftlich bzw. mit positiver Gesamtenergiebilanz fördern lässt. [6] Ein Abschätzen der Reichweite bekannter Vorräte ist schwierig, da Uran im Gegensatz zu fossilen Energieträgern keinen eindeutig definierbaren Heizwert besitzt. Die extrahierbare Energie pro Gewichtseinheit ist stark vom Brennstoffkreislauf, dem benutzten Reaktortyp und der Kernbeladungsstragie abhängig. Diese Eigenheit wird im unterschiedlichen Uranverbrauch einzelner Länder ersichtlich: So ist der Uranbedarf der USA laut Red Book ungefähr doppelt so hoch pro erzeugte Strommenge wie in Deutschland oder Frankreich. Eigenschaften
Uran ist ein sehr schweres (dichtes), relativ weiches, silber-weißes Metall, welches in fein verteiltem Zustand selbstentzündlich ist. Die meisten Säuren lösen metallisches Uran auf, während es von Alkalien nicht angegriffen wird. An der Luft überzieht sich das Metall mit einer Oxidschicht. Uran kommt in drei Modifikationen vor: α-Uran bei Temperaturen unter 688 °C, β-Uran im Temperaturbereich zwischen 688 und 776 °C und γ-Uran im Temperaturbereich zwischen 776 °C und seinem Schmelzpunkt (1132 °C). Aus Uran und seinen Zerfallsprodukten entstehen ständig eine Reihe kurzlebiger Tochternuklide, von denen einige, aufgrund ihrer Gasförmigkeit, sehr mobil sind, wie z. B. das Edelgas Radon. Uran selbst ist zwar ein Alphastrahler, aber es ist bei Umgang und Lagerung von Uran und seinen Verbindungen zu beachten, dass stets auch einige Mitglieder der Zerfallsreihe anwesend sind, die relativ durchdringungsfähige Beta- und Gammastrahlen emittieren. Uran-Rhodium-Germanium (URhGe) ist die erste entdeckte Legierung, die in sehr starken Magnetfeldern eine reentrante Supraleitung zeigt.[7]
´ IsotopeIn natürlichem Uran finden sich die Isotope 238U (99,27 %), 235U (0,72 %) und 234U (0,0055 %). Uran 238U hat eine Halbwertszeit von 4,468 Milliarden Jahren und ist wie die anderen natürlichen Isotope (234U und 235U) ein α-Strahler. Die spezifische Aktivität von 238U beträgt 12450 Bq/g. 238U ist der natürliche Beginn der Uran-Radium-Reihe. Als „angereichert“ wird Uran bezeichnet, dessen Anteil an (mit thermischen Neutronen spaltbarem) 235U gegenüber dem (mit thermischen Neutronen nicht spaltbarem) 238U durch Uran-Anreicherung erhöht wurde. Schwach angereichertes Uran (etwa 2–4 % 235U) wird in Kernkraftwerken, hoch angereichertes (typisch > 80 % 235U) zur Herstellung von Kernwaffen und zur Produktion von Neutronen für Neutronenstreuexperimente verwendet. Die kritische Masse von 235U beträgt etwa 49 kg. 235U ist der natürliche Beginn der Uran-Actinium-Reihe, seine Halbwertszeit beträgt 703,8 Mio. Jahre. Wegen seiner relativ kurzen Halbwertszeit im Vergleich zu 238U ist 234U nur in Spuren vorhanden, liefert aber einen gleich großen Beitrag zur Radioaktivität wie ersteres. Es entsteht gemäß
Die Zeitangaben sind Halbwertszeiten. Uran 234U hat eine Halbwertszeit von 245.500 Jahren und zerfällt über die Uran-Radium-Reihe. Das Alphastrahlende Isotop 236U mit einer Halbwertszeit von 23 Millionen Jahren kommt in der Natur nur in Spuren vor.[8] Es entsteht durch Neutroneneinfang aus 235U. Wenn Uran einem erhöhten Neutronenfluss ausgesetzt ist, wie z. B. in einem Kernreaktor, erhöht sich der Anteil an 236U deutlich.[9] Die Anteile der Isotope 234U, 235U, 236U in einer Urankontamination können Aufschluss über den Ursprung einer Urankontamination geben.[10] 236U zerfällt über die bis zum natürlichen Plutonium 244Pu verlängerte Thorium-Reihe. Das künstliche spaltbare Uranisotop 233U wird in Thorium-Hochtemperaturreaktoren aus dem unspaltbarem Thorium 232Th erbrütet und verbraucht. Uran 233U hat eine Halbwertszeit von 159.200 Jahren und eine Kritische Masse von nur ca. 16,5 kg. 233U zerfällt über die Neptunium-Reihe. Die Zeitangaben sind Halbwertszeiten. Verwendung
Das Uranisotop 235U wird in Atomkraftwerken zur Energiegewinnung genutzt, das Isotop 238U kann in Brutreaktoren eingesetzt werden, um Plutonium herzustellen. Das Isotop 235U kommt in nur geringer Konzentration (etwa 0,72 %) im natürlichen Uran vor und wird durch Anreicherung konzentriert. Die zurückbleibende Fraktion wird auch abgereichertes Uran genannt (Abreicherung). 235U ist neben Plutonium das wichtigste Ausgangsmaterial für den Bau von Kernwaffen und Zündsätzen für Wasserstoffbomben. Aufgrund seines hohen Absorptionsquerschnittes für ionisierende Strahlung wird abgereichertes Uran (depleted uranium, DU) in einigen Ländern in Abschirmblechen in der Atomindustrie eingesetzt. Im Flugzeugmodell Boeing 747 (Jumbojet) wurde es wegen seiner hohen Dichte als Gegengewicht im Heck eingesetzt. Viele Streitkräfte nutzen es in Form von Uranmunition als Projektilkernmaterial für panzerbrechende Munition. Die (depleted uranium) DU-Munition wird beim Eintritt in den Panzerinnenraum zerstäubt und verbrennt dabei explosionsartig. Die entstehenden Stäube und Aerosole sind giftig und führen zu Gesundheitsschäden bei kontaminierten Personen. In jüngster Zeit wurden mehrere hundert Tonnen Uranmunition in indisch-pakistanischen Grenzkonflikten, in Tschetschenien, während der sowjetischen Invasion Afghanistans, im Kosovo-Krieg, im Zweiten Golfkrieg und im Irak-Krieg von den beteiligten Parteien eingesetzt. Abgereichertes Uran wird in Panzern (z. B. M1 Abrams) als Panzerung eingesetzt. Es handelt sich um eine Sandwichpanzerung mit einer Schicht Uran zwischen zwei Schichten Panzerstahl. VerbindungenUran tritt in der Natur überwiegend mit den Wertigkeiten +4 oder +6 auf. Vierwertige Uranminerale sind in Wasser unter normalen pH/EH-Bedingungen nahezu unlöslich. Das sechswertige Uran ist dagegen unter oxidierenden Bedingungen auch im Bereich neutraler pH-Werte gut löslich, weil es sehr stabile Komplexe bildet. Uran, wie andere Actinoide, formt leicht zweifach positive Uranylkationen (UO22+). In der Natur bildet dieser Kern in wässriger Lösung die Uranylcarbonatokomplexe UO2(CO3)x2(x−1)−, sowie mit anderen sauerstoffhaltigen Molekülanionen OH−, Nitrat- (NO3−), Sulfat- (SO4−2) und Phosphatokomplexe:
Diese geladenen Komplexe sind sehr mobil. Urantetrafluorid (UF4), auch bekannt als „green salt“, ist ein Zwischenprodukt der Herstellung von Uranhexafluorid (UF6). Uranhexafluorid ist ein weißer Feststoff, der bei einer Temperatur von 56 °C sublimiert und nur unter Druck bei 64,1°C schmilzt. UF6 ist die Uranverbindung, die für die zwei häufigsten Anreicherungsprozesse, Gasdiffusion und Gaszentrifuge verwendet wird. Es wird in der Industrie schlicht als „Hexe“ bezeichnet. Yellowcake ist Uranoxidkonzentrat. Der Name ist abgeleitet von der früheren Farbe und Textur. Heutzutage werden höhere Kalzinationstemperaturen verwendet, wodurch der „gelbe Kuchen“ eher dunkelgrün bis schwarz ist. Ursprünglich waren die im Yellowcake enthaltenen chemischen Verbindungen unbekannt. Noch in den 70er Jahren bezeichnete das U.S. Bureau of Mines (engl.) das Material als „Endprodukt der Verhüttung“. Man nahm an, dass es sich um Ammoniumdiuranat oder Natriumdiuranat handelt. Die Zusammensetzung variierte und hing vom Verhüttungsprozess ab. Die Verbindungen, die in Yellowcake gefunden wurden, sind unter anderem Uranylhydroxid, Uranylsulfat, Natrium-para-Uranat und Uranylperoxid, zusammen mit einer Reihe von Uranoxiden. Der heutige Yellowcake enthält typischerweise zu 70 bis 90 Gewichtsprozenten Uranoxid (U3O8). Andere Uranoxide, wie UO2 und UO3 existieren ebenfalls, das stabilste, U3O8, wird als 2:3 Mischung der ersten beiden angesehen. Urandioxid ist ein schwarzes, kristallines Pulver, das im späten 19. Jahrhundert bis in die Mitte des 20. Jahrhunderts als Keramikglasur verwendet wurde. Heutzutage wird es vor allem als nuklearer Brennstoff in Brennstäben eingesetzt. Das hellgelbe Ammoniumdiuranat ist ein Zwischenprodukt bei der Herstellung von Yellowcake. Manchmal wird es ebenfalls als „Yellowcake“ bezeichnet, das entspricht allerdings nicht dem allgemeinen Gebrauch. Uranylnitrat (UO2(NO3)2) ist ein sehr giftiges, lösliches Uransalz. Uranverbindungen sind giftig. Die Toxizität wird v. a. durch deren Löslichkeit bestimmt. Die leichtlöslichen Uranyl-Salze sind am giftigsten, die schwerlöslichen Oxide sind weniger giftig. Uran ist teratogen. Literatur
Quellenangaben
Kategorien: Giftiger Stoff | Radioaktiver Stoff | Actinoid | Periode-7-Element | Uran | Chemisches Element | Nukleares Material | Schwermetall |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Uran aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||






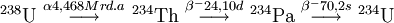 .
.