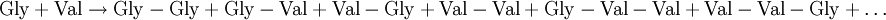Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
PeptidEin Peptid ist eine organische chemische Verbindung, die aus einer Verknüpfung mehrerer Aminosäuren hervorgegangen ist. Dabei sind die einzelnen Aminosäuren in einer definierten Reihenfolge (Sequenz) zu einer, meist unverzweigten, Kette verbunden. Die Aminosäuren in einem Peptid sind über eine Amidbindung miteinander verknüpft. Wegen der großen Bedeutung der Peptide in der Biochemie und organischen Chemie wird diese Form der Bindung häufig auch Peptidbindung genannt. Als Peptide bezeichnet man relativ kurze Aminosäureketten von bis zu etwa 50 (i.A. maximal 100) Aminosäuren. Peptide unterscheiden sich von Proteinen allein durch ihre Größe. Die Trennung zwischen Peptiden und Proteinen ist nicht scharf und ist mehr oder weniger willkürlich gewählt. Die Grenze liegt ungefähr bei 100 Aminosäuren. In der Natur werden Peptide vorwiegend durch die Proteinbiosynthese gebildet. Die Information über die Sequenz, also Abfolge der Aminosäuren, ist in der DNA codiert. Peptide erfüllen eine große Anzahl an Funktionen. Die Wirkungsweise ist dabei jedoch in den meisten Fällen nur ansatzweise verstanden. Es gibt Beispiele für Peptide, die als Hormone wirken, andere wiederum zeigen eine entzündungshemmende oder entzündungsfördernde Wirkung, darüberhinaus gibt es antibiotische und antivirale Peptide. Einige in der Nahrung häufig auftretende Proteine wie Gluten, Kasein oder auch in Ei oder Spinat vorhandene Eiweiße können durch die Verdauungsprozesse zu sogenannten opioiden Peptiden umgesetzt werden. Diese Peptide wirken in ähnlicher Weise wie Morphin auf den Körper. Personen, die nicht in der Lage sind diese Peptide weiter zu verstoffwechseln, können Anzeichen körperlicher und geistiger Krankheit entwickeln. Der Begriff Peptid wurde von Emil Fischer geprägt (1906). Peptid wurde aus Pepton (peptos (griech.: verdaut)), den Proteinabbauprodukten des Pepsines und der Endung von Poly-Saccharid, wegen der Analogie zu ihrem Aufbau aus Monomeren, zusammengesetzt. Produkt-Highlight
StrukturBei der Kondensation von Aminosäuren reagiert die Carboxyl-Gruppe der einen Aminosäure formal unter Wasseraustritt mit der Aminogruppe der anderen Aminosäure zur Säureamidgruppierung -CO-NH- (Peptidbindung). Die freie Aminogruppe an einem Ende des Peptids nennt man N-Terminus, die freie Carboxylgruppe am anderen Ende wird C-Terminus genannt. EinteilungGenerell bezeichnet man die Anzahl der Aminosäuren, aus denen ein Peptidmolekül besteht, auch als Kettenlänge. Anhand der Kettenlänge differenziert man in
und
wobei die eingerückten Peptidgruppen nur eine feinere Einteilung der Oligo- und Polypeptiden darstellt. Die Abgrenzung zwischen Oligo- und Polypeptiden einerseits und zwischen Polypeptiden und Proteinen andererseits ist dabei nicht scharf; die angegebenen Grenzen der Kettenlängen sind vielmehr grobe Richtwerte. OligopeptideAls Oligopeptide werden chemische Verbindungen bezeichnet, die aus bis zu zehn Aminosäuren bestehen, die untereinander über Peptidbindungen verknüpft sind. Gebildet wird ein Oligopeptid indem unter Wasserabspaltung die Aminogruppe einer ersten Aminosäure mit der Carboxylgruppe einer zweiten Aminosäure reagiert. Daraufhin reagiert die freie Aminogruppe des entstandenen Dipeptids mit der Carboxylgruppe einer weiteren Aminosäure. Nach diesem Muster werden die übrigen Aminosäuren angeknüpft, so dass eine kurze Kette von Aminosäuren entsteht, die über Peptidbindungen miteinander verbunden sind. Oligopeptide spielen z. B. als Bestandteile von Enzymen bei Entgiftungs-, Transport- und Stoffwechselprozessen eine Rolle. Dipeptidesiehe Artikel Dipeptid PolypeptideEin Polypeptid ist ein Peptid, das aus mindestens zehn Aminosäuren besteht, kürzere Polypeptide werden als Oligopeptid bezeichnet. Die Aminosäuren sind durch Peptidbindungen verbunden. Polypeptide können sowohl natürlichen als auch synthetischen Ursprungs sein. Polypeptide mit über 100 Aminosäuren werden in der Regel als Proteine bezeichnet; allerdings sind für ein Protein weitere Voraussetzungen notwendig, so etwa eine definierte Proteinfaltung. In der Natur werden Polypeptide durch die Mechanismen der Proteinbiosynthese aufgrund der Bauvorschrift, die in der DNA bzw RNA codiert ist, gebildet. Sind hochmolekulare Makropeptide durch Wasserstoff- oder Disulfidbrücken verbunden, nennt man diese Proteine. Je nach geschichtlicher Einordnung werden auch einige Aminosäurenketten mit über 100 Aminosäuren als Peptide bezeichnet. PeptidsyntheseDie Synthesemethode der Wahl für ein Peptid bestimmter Sequenz unterscheidet sich je nach dessen Länge:
Wird versucht ein bestimmtes Dipetid (z.B. Gly-Val) aus zwei verschiednen Aminosäuren (Gly + Val) durch thermische Dehydratisierung herzustellen werden eine Reihe von unerwünschten Produkten in beachtlicher Menge entstehen[1]:
Um die Selektivität (Chemie) zu erhöhen, werden die Carboxyl- und Aminogruppen die nicht verküpft werden sollen mit einer Schutzgruppe versehen (z.B Ester, Boc):
Neben dieser Art der chemischen Synthese werden heute meist Festphasensynthesen angewendet. Zudem können auch Enzyme zur Peptidsynthese eingesetzt werden. Siehe auchQuellen
Kategorien: Peptid | Stoffgruppe |
|
| Dieser Artikel basiert auf dem Artikel Peptid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |