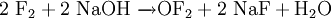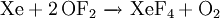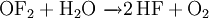Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Sauerstoffdifluorid
Sauerstoffdifluorid ist ein Fluorid des Sauerstoffs mit der Summenformel OF2. Oft wird er fälschlicherweise als Difluoroxid bezeichnet. Er gehört zu den Sauerstofffluoriden und ist einer von sehr wenigen Stoffen, in dem Sauerstoff mit einer positiven Oxidationszahl auftritt. Produkt-Highlight
Gewinnung und DarstellungÜber Sauerstoffdifluorid wurde 1929 das erste Mal berichtet, dargestellt wurde es bei der Elektrolyse von geschmolzenem Kaliumfluorid und Fluorwasserstoff in Wasser. Heutzutage wird Sauerstoffdifluorid durch die Reaktion von Fluor mit Natriumhydroxid gewonnen: EigenschaftenSauerstoffdifluorid ist eines der stärksten bekannten Oxidationsmittel, das sogar das Edelgas Xenon zu Xenontetrafluorid (XeF4) oxidieren kann: In Wasser gelöst reagiert Sauerstoffdifluorid mit Wasser zu Fluorwasserstoff und Sauerstoff (Komproportionierung): Es kondensiert bei -144,8 °C zu einer orangefarbenen Flüssigkeit, die von der Struktur her an Wasser erinnert. VerwendungSauerstoffdifluorid wurde als Oxidationsmittel für Raketentreibstoffe[2] untersucht, da es einen hohen spezifischen Impuls liefert (z.B. zusammen mit Lithiumhydrid 4112 m/s[3]). SicherheitshinweiseAufgrund seiner extrem starken oxidierenden Wirkung ist Sauerstoffdifluorid ein für Mensch und Tier gefährlicher Stoff. Quellen
Kategorien: Brandfördernder Stoff | Giftiger Stoff |
||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Sauerstoffdifluorid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||