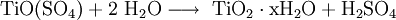Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Titan(IV)-oxid
Titan(IV)-oxid (Titandioxid) ist eines der Oxide des Titans. Produkt-Highlight
VorkommenTitan(IV)-oxid kommt in der Natur in drei Modifikationen vor:
Da die natürlichen Vorkommen störende Färbungen aufweisen, die z. B. durch Eisen im Ilmenit (FeTiO3) hervorgerufen werden, werden diese im Sulfatverfahren oder Chloridverfahren (bevorzugt) raffiniert. Gewinnung und DarstellungDurch Solvolyse (Hydrolyse) der Ti(IV)-Verbindung: EigenschaftenDer Schmelzpunkt von Titandioxid liegt bei 1855 °C. Es ist thermisch stabil, beständig, hat einen hohen Brechungsindex (2,8) und daher ein großes Färbe- und Deckvermögen. Titandioxid ist chemisch sehr inert. Es ist lichtbeständig, preiswert, völlig ungiftig und daher das bedeutendste Weißpigment. VerwendungTitandioxid findet als weißes Farbmittel Verwendung. Es wurde 1908 in Norwegen und den USA entdeckt und dort ab 1909 unter der Bezeichnung Kronos-Titanweiß hergestellt. In Deutschland begann die Produktion im Jahr 1924 unter dem Namen Degea-Titanweiß. Bis 1938 wurde das Titanweiß nur in der Anatasform hergestellt, dann aber vornehmlich in der Rutilform, die sich als stabiler gegenüber Ölbindemitteln und organischen Farbstoffen erwies. Es wurde daher auch als Rutilweiß bezeichnet. Titanweiß hat die höchste Deckkraft aller Weißpigmente und ein hervorragendes Aufhellungsvermögen. Es ist chemisch stabil, ungiftig und unter der Kennzeichnung E 171 als Lebensmittelzusatzstoff beispielsweise in Zahnpasta und Hustenbonbons anzutreffen. Auch in der Ölmalerei findet es teilweise Verwendung. Im technischen Bereich findet es Verwendung in Farben und Lacken (z. B. für Wandfarbe und Textilien), in Papier sowie als UV-Blocker in Sonnencremes und Aufheller in Arzneimitteln (Tabletten). Der photokatalytische Effekt von TiO2 Nanopartikeln wird in Verbindung mit der UV-Aktivität für „selbstreinigende“ Oberflächen genutzt (photokatalytische Selbstreinigung). Wiederum auf den Halbleitereigenschaften des Titandioxids basiert die Farbstoffsolarzelle (Grätzel-Zelle). Titandioxid wird ebenfalls als Hauptbestandteil des Keramik-Dielektrikums in Klasse 1 Keramikkondensatoren eingesetzt. Titandioxid in der Anatas-Modifikation ist Hauptbestandteil der Katalysatoren, die für die industrielle Entstickung von Rauchgasen nach dem SCR-Verfahren eingesetzt werden. Bei der Herstellung von Titanoxid nach dem Sulfatverfahren entsteht Dünnsäure (verdünnte Schwefelsäure), die teilweise über Aufkonzentration für die Herstellung von Titanoxid wiederverwendet wird. In einigen Ländern wird diese Dünnsäure bis heute zum Teil in Flüsse und Meere geleitet oder verklappt. Beim Chloridverfahren entsteht dagegen keine Dünnsäure. Das verwendete Chlor bleibt weitgehend im Prozesskreislauf. TiO2 wird auch im Bereich der Fliesenveredelung verwendet, was dazu führt, dass die Oberflächen der behandelten Fliesen schmutzabweisend werden.[2] NachweisIn der Kälte frisch gefälltes Titandioxid ist amphoter und in verdünnten Mineralsäuren löslich. Ein Aufschluss erfolgt mit Kaliumhydrogensulfat im Porzellantiegel. Anschließend wird in kaltem Wasser mit etwas Schwefelsäure gelöst. Mit einigen Tropfen Wasserstoffperoxid bildet sich das gelbe (basisch) bis gelborange (sauer, Foto) [Ti(O2)·aq]2+-Kation. Mit Salzsäure und Zink(granalie) bildet sich nascierender Wasserstoff, der Ti(IV) zu rotviolettem [Ti(H2O)6]3+ reduziert. Siehe auchNanotechnologie Einzelnachweise
Kategorien: Oxid | Titanverbindung | Pigment | Halbleiter |
|||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Titan(IV)-oxid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||||