Erstmals chemische Bindungen zu künstlichen Atomen gemessen
Rasterkraftmikroskopie untersucht die Bindungseigenschaften des Quantencorrals
Anzeigen
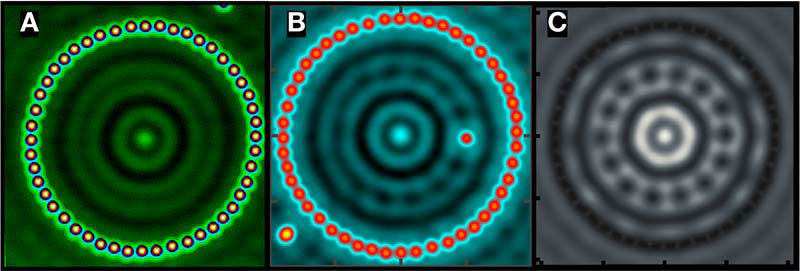
Atome bestehen aus einem sehr kleinen Kern, der von einer etwa 100.000 Mal größeren Elektronenhülle umgeben wird. Diese Elektronen haben quantisierte Energiezustände und bestimmen die mechanischen, elektronischen und optischen Eigenschaften der Materie. Künstliche Atome sind vom Menschen geschaffene Strukturen, die ebenfalls eine gewisse Zahl von Elektronen in quantisierte Zustände bringen. Ein Beispiel eines künstlichen Atoms ist der bereits 1993 von Crommie, Lutz und Eigler vorgestellte Quantencorral, ein Ring gebaut aus 48 Eisenatomen auf einer Kupferunterlage mit einem Durchmesser von 14 Nanometern (siehe Bild A). Der Eisenring schließt 102 Elektronen ein, die Dichte der Elektronen innerhalb des Rings sieht ähnlich aus wie die kreisförmige Wasserwelle, die sich bildet, wenn man einen Stein ins Wasser wirft. Die scheibenförmige, gewellte Verteilung der Elektronen kann man als Hülle eines künstlichen Atoms bezeichnen. Die Elektronendichte beträgt nur etwa ein Tausendstel von der eines natürlichen Atoms, weshalb es schwierig ist, die chemischen Bindungseigenschaften dieser künstlichen Elektronenhülle zu vermessen.
Universität Regensburg
Einer Gruppe von Forschern der Fakultät für Physik an der Universität Regensburg ist es nun erstmals gelungen, chemische Bindungen zu einem derartigen künstlichen Atom zu vermessen: Dazu haben die Wissenschaftler die Spitze eines Rasterkraftmikroskops an das künstliche Atom herangeführt und seine Bindungskraft bestimmt. Diese lag bei lediglich einem Pikonewton, etwa einem Tausendstel der Kraft, die bei Bindungen zu natürlichen Atomen auftritt.
Außerdem ist es möglich, die Geometrie im Inneren dieser künstlichen Atome gezielt zu ändern. So kann man, wie in Bild B gezeigt, ein (natürliches) Stör-Atom einbauen, um zu sehen wie die Hülle des künstlichen Atoms darauf reagiert. Die Störung verursacht zusätzlich zu den radialen Wellen auch noch azimuthale Oszillationen, wie durch quantenmechanische Rechnungen (Bild C) bestätigt wird.
Die Ergebnisse der Regensburger Physiker liefern nicht nur faszinierendes Anschauungsmaterial für die Wunder der Quantenmechanik, sondern könnten darüber hinaus in Quantencomputern Verwendung finden: Denkbar wäre ihr Einsatz zum Bau von Speicherzellen, sogenannten spezifizierten Qubits.