Forscher messen das Aufbrechen einer einzelnen chemischen Bindung
"Es ist ein unglaubliches Bild - ein einzelnes kleines Molekül auf einer Oberfläche zu sehen, an das ein anderes Molekül gebunden ist, ist erstaunlich"
Anzeigen
Das Team verwendete ein hochauflösendes Rasterkraftmikroskop (AFM), das in einer kontrollierten Umgebung im Princeton Imaging and Analysis Center betrieben wurde. Die AFM-Sonde, deren Spitze in einem einzelnen Kupferatom endet, wurde schrittweise näher an die Eisen-Kohlenstoff-Bindung herangeführt, bis diese zerbrach. Die Forscher maßen die mechanischen Kräfte, die im Moment des Bruchs auftraten, was auf einem vom Mikroskop aufgenommenen Bild zu sehen war. Ein Team der Princeton University, der University of Texas-Austin und von ExxonMobil berichtete über die Ergebnisse in einem am 24. September in Nature Communications veröffentlichten Artikel.
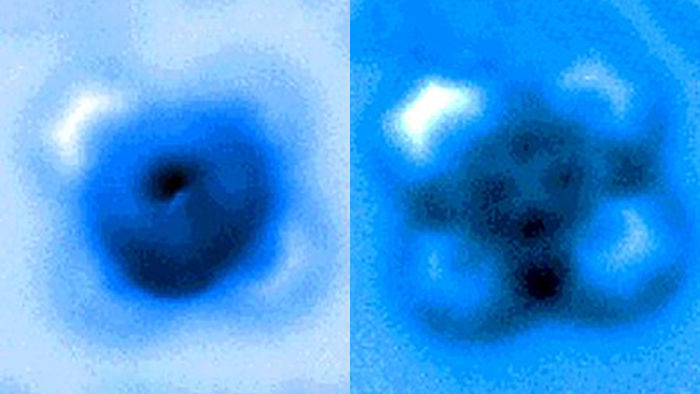
Die Forscher maßen die mechanischen Kräfte, die aufgebracht wurden, um eine Bindung zwischen Kohlenmonoxid und Eisenphthalocyanin zu brechen, die in den Rastersondenmikroskop-Bildern, die vor und nach dem Bruch der Bindung aufgenommen wurden, als symmetrisches Kreuz erscheint.
Pengcheng Chen et al.
"Es ist ein unglaubliches Bild - ein einzelnes kleines Molekül auf einer Oberfläche zu sehen, an das ein anderes gebunden ist, ist erstaunlich", sagte Mitautor Craig Arnold, Susan Dod Brown Professor für Maschinenbau und Luft- und Raumfahrttechnik und Direktor des Princeton Institute for the Science and Technology of Materials (PRISM).
"Die Tatsache, dass wir diese spezielle Bindung sowohl durch Zug als auch durch Druck charakterisieren konnten, ermöglicht es uns, viel mehr über die Beschaffenheit dieser Art von Bindungen zu verstehen - ihre Stärke, wie sie interagieren - und das hat alle möglichen Auswirkungen, insbesondere für die Katalyse, bei der ein Molekül auf einer Oberfläche liegt und dann etwas mit ihm interagiert und es zum Auseinanderbrechen bringt", so Arnold.
Nan Yao, einer der Hauptautoren der Studie und Direktor des Princeton Imaging and Analysis Center, merkte an, dass die Experimente auch Erkenntnisse darüber lieferten, wie sich das Aufbrechen von Bindungen auf die Wechselwirkungen eines Katalysators mit der Oberfläche auswirkt, an der er adsorbiert ist. Die Verbesserung des Designs chemischer Katalysatoren ist für die Biochemie, die Materialwissenschaften und die Energietechnologien von Bedeutung, fügte Yao hinzu, der auch Professor für Praxis und leitender Forschungswissenschaftler bei PRISM ist.
In den Experimenten war das Kohlenstoffatom Teil eines Kohlenmonoxidmoleküls und das Eisenatom stammte aus Eisenphthalocyanin, einem gängigen Pigment und chemischen Katalysator. Eisenphthalocyanin ist wie ein symmetrisches Kreuz aufgebaut, mit einem einzelnen Eisenatom im Zentrum eines Komplexes aus mit Stickstoff und Kohlenstoff verbundenen Ringen. Das Eisenatom interagiert mit dem Kohlenstoff des Kohlenmonoxids, und das Eisen und der Kohlenstoff teilen sich ein Elektronenpaar in einer Art kovalenter Bindung, die als dative Bindung bekannt ist.
Yao und seine Kollegen nutzten die atomare Sondenspitze des AFM-Instruments, um die Eisen-Kohlenstoff-Bindung zu brechen, indem sie den Abstand zwischen der Spitze und den gebundenen Molekülen bis auf 5 Pikometer (5 Milliardstel Millimeter) genau kontrollierten. Der Bruch erfolgte, als sich die Spitze 30 Pikometer über den Molekülen befand - ein Abstand, der etwa einem Sechstel der Breite eines Kohlenstoffatoms entspricht. In dieser Höhe wurde die Hälfte des Eisenphthalocyanin-Moleküls auf dem AFM-Bild unschärfer, was auf die Bruchstelle der chemischen Bindung hinweist.
Dabei berührt die Mikroskopspitze die zu untersuchenden Moleküle nicht direkt, sondern nutzt die Frequenzveränderungen der feinen Schwingungen, um ein Bild der Moleküloberfläche zu erstellen.
Durch die Messung dieser Frequenzverschiebungen konnten die Forscher auch die Kraft berechnen, die zum Brechen der Bindung erforderlich ist. Eine normale Kupferspitze brach die Eisen-Kohlenstoff-Bindung mit einer Anziehungskraft von 150 Pikonewton. Mit einem weiteren Kohlenmonoxidmolekül an der Spitze wurde die Bindung durch eine Abstoßungskraft von 220 Pikonewton gebrochen. Um die Ursachen für diese Unterschiede zu ergründen, setzte das Team Quantensimulationsmethoden ein, um Veränderungen der Elektronendichte bei chemischen Reaktionen zu modellieren.
Die Arbeit macht sich die 2009 erstmals entwickelte AFM-Technologie zunutze, um einzelne chemische Bindungen sichtbar zu machen. Das kontrollierte Aufbrechen einer chemischen Bindung mit einem AFM-System war eine größere Herausforderung als ähnliche Studien zur Bindungsbildung.
"Es ist eine große Herausforderung, unser Verständnis dafür zu verbessern, wie chemische Reaktionen durch die Manipulation von Atomen, d. h. mit der Spitze eines Rastersondenmikroskops, durchgeführt werden können", sagte Leo Gross, Leiter der Forschungsgruppe Atom and Molecule Manipulation bei IBM Research in Zürich und Hauptautor der Studie aus dem Jahr 2009, in der erstmals die chemische Struktur eines Moleküls mit AFM aufgelöst wurde.
Durch das Brechen einer bestimmten Bindung mit verschiedenen Spitzen, die zwei unterschiedliche Mechanismen nutzen, trägt die neue Studie dazu bei, "unser Verständnis und unsere Kontrolle der Bindungsspaltung durch Atommanipulation zu verbessern. Sie erweitert unser Instrumentarium für die Chemie durch Atommanipulation und ist ein Schritt in Richtung der Herstellung immer komplexerer Moleküle", fügte Gross hinzu, der nicht an der Studie beteiligt war.
Die Experimente reagieren sehr empfindlich auf externe Vibrationen und andere Störfaktoren. Das spezielle AFM-Instrument des Imaging and Analysis Center ist in einer Hochvakuumumgebung untergebracht, und die Materialien werden mit flüssigem Helium auf eine Temperatur von 4 Kelvin, nur wenige Grad über dem absoluten Nullpunkt, gekühlt. Diese kontrollierten Bedingungen ermöglichen präzise Messungen, da sichergestellt ist, dass die Energiezustände und Wechselwirkungen der Moleküle nur durch die experimentellen Manipulationen beeinflusst werden.
"Man braucht ein sehr gutes, sauberes System, weil diese Reaktion sehr kompliziert sein kann - bei so vielen beteiligten Atomen weiß man vielleicht nicht, welche Bindung man auf einer so kleinen Skala bricht", sagt Yao. "Das Design dieses Systems vereinfachte den gesamten Prozess und klärte das Unbekannte beim Brechen einer chemischen Bindung", sagte er.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.






























































