Modellsystem führt auf die Spur von Alterungsprozessen elastischer Polymere
Anzeigen
Nicht nur an uns Menschen nagt der Zahn der Zeit, auch viele Materialien ändern ihre Eigenschaften mit fortschreitendem Alter. Obwohl solche Phänomene in vielen Bereichen zu finden sind, entziehen sich die ihnen zugrunde liegenden Prozesse in vielen Fällen noch einem genaueren Verständnis. Von besonderem Interesse sind dabei polymere Materialien, wie sie in Kunststoffen und biologischen Systemen zu finden sind. Einer Gruppe um Physiker der Technischen Universität München (TUM) ist es nun gelungen wesentliche Aspekte dieser Vorgänge aufzuklären.
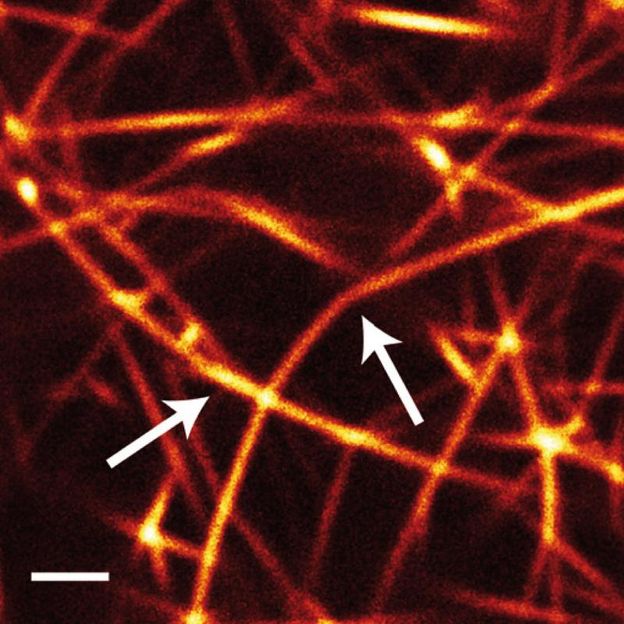
Knicke in den Aktinfaser-Bündeln lassen darauf schließen, dass bei der Bildung des Netzwerks Spannungsenergie gespeichert wird, die bei Umordnungen im Lauf der Zeit abgebaut wird und damit keinen Beitrag mehr zur Elastizität des Material leisten kann. (Der Messbalken entspricht 2 µm)
TUM
Beobachtet man ein Material über einen ausreichend langen Zeitraum, lassen sich häufig Veränderungen in dessen mechanischen Eigenschaften feststellen. Wie diese Entwicklungen verlaufen hängt von den zugrunde liegenden mikroskopischen Mechanismen ab. Aufgrund der mikroskopischen Struktur und Komplexität der Systeme ist eine direkte Beobachtung jedoch äußerst schwierig.
Ein Team um Professor Andreas Bausch, vom Lehrstuhl für Zellbiophysik, nutzt daher ein exakt kontrollierbares Modellsystem auf der Basis von Aktin-Fasern, einem Biopolymer das im menschlichen Körper unter anderem die Kontraktion von Muskeln ermöglicht. Gemeinsam mit dem Quervernetzermolekül Fascin bilden diese ein verknüpftes Netzwerk, dessen Elastizität mit zunehmendem Alter sinkt. Mit einer breitgefächerten Kombination an experimentellen Techniken ist es den Forschern nun gelungen, den Ursprung dieser Veränderungen aufzuklären.
Wie die bei Nature Materials veröffentlichte Untersuchung zeigt, sind mikroskopische Entspannungsprozesse der Grund für die makroskopischen Eigenschaftsänderungen des Polymernetzwerkes. Während der Entstehung des Netzwerks bauen sich innere Spannungen auf. Da die Verknüpfungspunkte des Netzwerkes aber nicht von permanenter Natur sind, sondern sich in zufälligen Intervallen öffnen und schließen, werden diese Spannungen nach und nach abgebaut. Im Verlauf von etwa zehn Stunden sinkt die Elastizität auf etwa ein Fünftel des Anfangswertes und bleibt dann stabil.
„Vernetzte Aktinfaserbündel bilden Netzwerke, die für die Stabilität lebender Zellen essenziell sind,“ sagt Andreas Bausch, Inhaber des Lehrstuhls für Zellbiophysik der TU München und Mitglied des Exzellenzclusters Nanosystems Initiative Munich (NIM). „Indem wir die mikroskopischen Ursachen der unglaublichen Wandlungsfähigkeit des Zellskeletts besser verstehen lernen, legen wir die Grundlagen, auch die Entwicklung anderer polymerer Materialien weiter voran zu treiben.“
Die Arbeiten wurden unterstützt aus Mitteln der Deutschen Forschungsgemeinschaft (Exzellenzcluster Nanosystems Initiative Munich, NIM), des Deutschen Akademischen Auslandsdienstes, des Bayerischen Elitenetzwerks (CompInt), des CNES und der Région Languedoc Roussillon sowie dem Institut Universitaire de France.































































