Wie Enzyme Wasserstoff produzieren
Mechanismus aufgeklärt
Anzeigen
Jahrelang hatten Forscher angenommen, dass es bei der Reaktion einen hoch instabilen Zwischenzustand geben müsse. Nachweisen konnte ihn niemand. Bis jetzt.
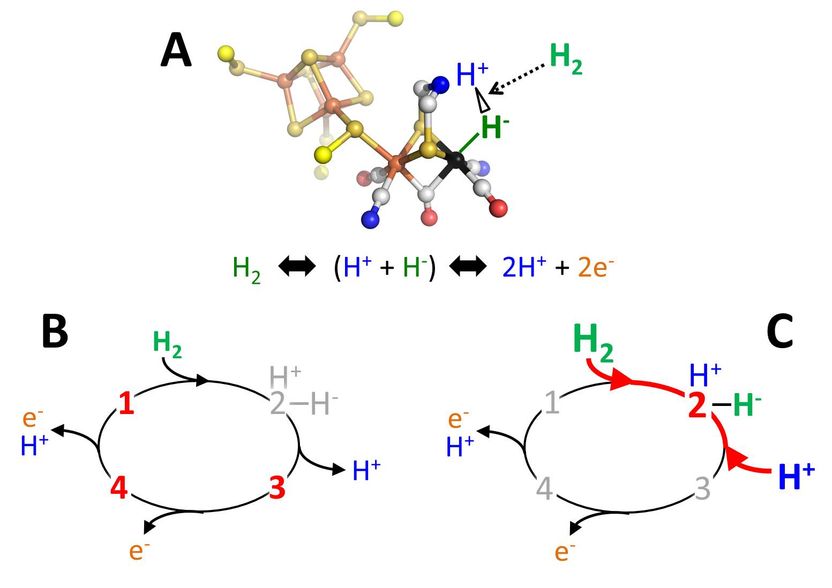
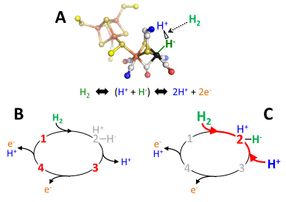
A: Am H-Cluster können Elektronen (e-) und Protonen (H+) zu molekularem Wasserstoff (H2) umgesetzt werden oder Wasserstoff in Elektronen und Protonen gespalten werden. B: Forscher gehen davon aus, dass die Hydrogenase vier Zustände in einem Reaktionszyklus durchläuft (durch die Ziffern 1 bis 4 gekennzeichnet). Zustand 2 ist der wichtigste Zwischenzustand: Wasserstoff (H2) wird ungleichmäßig in H+ und H- gespalten. Das Hydrid-Ion (H-) ist an das Enzym gebunden. Da Zustand 2 sehr instabil ist, reagiert er umgehend weiter zu 3 und 4 und konnte im Gegensatz zu den Zuständen 1, 3 und 4 bisher noch nicht nachgewiesen werden. C: Um Zustand 2 nachzuweisen, wurde das chemische Gleichgewicht zugunsten dieses Zustands verschoben, indem die Konzentrationen des Wasserstoffs und der Protonen erhöht wurden (rote Pfeile).
© Martin Winkler

Martin Winkler (rechts) und Thomas Happe (links) haben einen flüchtigen Zwischenzustand eines Enzyms dingfest gemacht.
© RUB, Marquard

Den entscheidenden Katalyseschritt bei der Wasserstoffproduktion durch Enzyme haben Forscher der Ruhr-Universität Bochum und der Freien Universität Berlin aufgeklärt. Die Enzyme, sogenannte Hydrogenasen, setzen Elektronen und Protonen effizient zu Wasserstoff um. Sie sind daher ein Kandidat für die biotechnologische Herstellung des potenziellen Energieträgers. „Um Wasserstoff in industriellem Maßstab mithilfe von Enzymen zu erzeugen, müssen wir deren Funktionsweise genau verstehen“, sagt Prof. Dr. Thomas Happe, einer der Autoren der Studie.
Das Team um Happe und Dr. Martin Winkler von der Bochumer Arbeitsgruppe für Photobiotechnologie berichtet über die Ergebnisse mit Berliner Kollegen um Dr. Sven Stripp in der Zeitschrift Nature Communications.
Enzym arbeitet in zwei Richtungen
Hydrogenasen können in zwei Richtungen arbeiten: Sie setzen Protonen und Elektronen zu Wasserstoff um oder spalten Wasserstoff in Protonen und Elektronen. Diese Reaktionen finden an dem aktiven Zentrum der Hydrogenase statt, das eine komplexe Struktur aus sechs Eisen- und sechs Schwefelatomen ist, genannt H-Cluster. Während des Katalyseprozesses durchläuft dieser Cluster mehrere Zwischenzustände.
Bei der Spaltung von molekularem Wasserstoff (H2) bindet das Wasserstoffmolekül zunächst an den H-Cluster. „Hydrogenase-Forscher waren von jeher davon überzeugt, dass im ersten Reaktionsschritt eine ungleichmäßige Spaltung von H2 erfolgen müsse“, erklärt Martin Winkler. Die Idee: Es entsteht ein positiv geladenes Proton (H+) und ein negativ geladenes Hydrid-Ion (H-), die dann schnell zu zwei Protonen und zwei Elektronen weiterreagieren. „Der Hydrid-Zustand des aktiven Enzyms, in dem also das Hydrid-Ion an das aktive Zentrum gebunden ist, gilt als hochgradig instabil – nachweisen konnte ihn bislang niemand“, so Winkler. Genau das gelang den Forschern nun.
Trick macht instabilen Zustand sichtbar
Mit einem Trick reicherten sie den H-Cluster-Zustand mit dem Hydrid-Ion an, sodass er sich spektroskopisch nachweisen ließ. Während der Wasserstoffspaltung stellt sich ein chemisches Gleichgewicht zwischen den beteiligten Reaktionspartnern – Protonen, Hydrid-Ionen und Wasserstoffmoleküle – ein. Im Gleichgewicht liegen stabile Konzentrationen der drei Wasserstoffzustände vor. Indem die Forscher von außen große Mengen an Protonen und Wasserstoff zu dem Gemisch hinzugaben, verschoben sie das Gleichgewicht – zugunsten der Hydrid-Produktion. Das aktive Zentrum mit dem negativ geladenen Hydrid-Ion reicherte sich nun in größerer Menge an; genug, um messbar zu sein.
Den Hydrid-Zwischenzustand, der auch bei der Wasserstoffproduktion entsteht, wies das Team auch noch in weiteren Versuchen mit gezielt veränderten Hydrogenasen nach.
„So konnten wir das Katalyseprinzip dieser Hydrogenasen erstmals experimentell belegen“, resümiert Thomas Happe. „Das liefert eine entscheidende Grundlage, um den hochgradig effektiven Umsatzmechanismus des H-Clusters für die industrielle Erzeugung von Wasserstoff zu reproduzieren.“ Die Enzyme können bis zu 10.000 Wasserstoffmoleküle pro Sekunde umsetzen.