Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Diffusion
Diffusion beruht auf der thermischen Bewegung von Teilchen. Bei den Teilchen kann es sich um Atome, Moleküle, Ionen, aber z. B. auch um andere Ladungsträger wie Elektronen oder Defektelektronen („Löcher“) handeln. Bei ungleichmäßiger Verteilung bewegen sich statistisch mehr Teilchen aus Bereichen hoher in Bereiche geringer Konzentration bzw. Teilchendichte als umgekehrt. Dadurch wird netto ein makroskopischer Stofftransport bewirkt. Unter Diffusion versteht man in der Regel diesen Netto-Transport. Der Begriff wird aber auch für den zugrundeliegenden mikroskopischen Prozess verwendet.
In einem abgeschlossenen System bewirkt Diffusion den Abbau von Konzentrationsunterschieden bis hin zur vollständigen Durchmischung. Die Zeit, die dafür benötigt wird, wächst mit dem Quadrat des Abstands. Diffusion ist daher vor allem auf Nano- bis Millimeter-Skalen wirksam; auf größeren Skalen dominiert in Flüssigkeiten und Gasen in der Regel Stofftransport durch Strömung (Konvektion). Diffusion kann auch durch eine poröse Wand oder Membran hindurch erfolgen. Osmose ist die Diffusion von Lösungsmittel durch eine für den gelösten Stoff undurchdringbare (semipermeable) Membran. Weiteres empfehlenswertes Fachwissen
VeranschaulichungEin oft genanntes Experiment zur Veranschaulichung der Ausbreitung durch Diffusion ist die allmähliche Einfärbung von lauwarmem Wasser durch einen Tropfen Tinte, den man hineingibt, das Wasser aber weder umrührt noch den Behälter schüttelt. Nach einiger Zeit hat sich die Tintenfarbe im ganzen Wasser gleichmäßig verteilt. Bei der Ausbreitung der Tinte im Wasser spielen neben reinen Diffusionserscheinungen auch Dichte- und Temperaturunterschiede eine Rolle. Dies lässt sich vermeiden, indem man eine farbige Flüssigkeit mit höherer Dichte mit einer niedrigerer Dichte überschichtet und sehr viskose Flüssigkeiten verwendet, z. B. farbigen Sirup und Honig. Die dann beobachtete allmähliche Einfärbung des Honigs erklärt sich nahezu ausschließlich durch Diffusion, wobei sowohl Sirup in den Honig, als auch Honig in den Sirup diffundiert. Physikalische GrundlagenDie Diffusion bei einer bestimmten konstanten Temperatur erfolgt ohne weitere Energiezufuhr und ist in diesem Sinne passiv; vor allem in der Biologie wird die Diffusion vom aktiven Transport unterschieden. Theoretisch ist Diffusion ein unendlich lange dauernder Vorgang. Im Rahmen der Messbarkeit kann sie jedoch häufig als in endlicher Zeit abgeschlossen betrachtet werden. Thermische BewegungDie thermische Bewegung, auf der die Diffusion beruht, kann je nach betrachtetem System sehr unterschiedlichen Charakter haben. In Gasen besteht sie aus geradliniger Bewegung, unterbrochen von gelegentlichen Stößen. Die schnelle thermische Bewegung von Flüssigkeitsteilchen bewirkt durch häufige Stöße die wesentlich langsamere, unter dem Mikroskop beobachtbare Brownsche Bewegung mesoskopischer Objekte. In Festkörpern erfolgen gelegentliche Ortswechsel, z. B. durch den Platztausch zweier benachbarter Teilchen oder das „Wandern“ von Leerstellen. Wahrscheinlichkeit und EntropieDie Bewegungsrichtung eines einzelnen Teilchens ist vollkommen zufällig. Aufgrund der Wechselwirkung mit anderen Teilchen erfolgen ständige Richtungsänderungen. Über einen längeren Zeitraum bzw. über viele Teilchen gemittelt kann sich dennoch ein Transport in eine bestimmte Richtung ergeben, z. B. wenn ein Sprung in eine bestimmte Richtung eine, vielleicht nur geringfügig, größere Wahrscheinlichkeit hat. Dies ist der Fall, wenn ein Konzentrationsunterschied (auch Konzentrationsgradient) vorhanden ist. Es entsteht dann ein Nettofluss an Teilchen, bis sich ein stationärer Zustand, das thermodynamische Gleichgewicht, einstellt. Zumeist ist der Gleichgewichtszustand die Gleichverteilung, bei der die Konzentration aller Teilchen an jedem Punkt im Raum gleich hoch ist.
Systeme, in denen die Teilchen regellos über das ganze Volumen verteilt sind, haben eine höhere Entropie als geordnetere Systeme, in denen sich die Teilchen bevorzugt in bestimmten Bereichen aufhalten. Diffusion führt damit zu einer Entropieerhöhung. Sie ist nach dem Zweiten Hauptsatz der Thermodynamik ein freiwillig ablaufender Prozess, der sich nicht ohne äußere Einwirkung umkehren lässt. Analogie zur Wärmeleitung und Leitung von elektrischem StromDie Diffusion folgt Gesetzmäßigkeiten, die denen der Wärmeleitung[1] äquivalent sind. Daher kann man Gleichungen, die den einen Prozess beschreiben, für den anderen übernehmen. Diffusion gelöster TeilchenBei festgelegtem Druck (p) und festgelegter Temperatur (T) ist aus dem Blickwinkel der chemischen Thermodynamik der Gradient des chemischen Potenzials µ die treibende Ursache des Stoffstroms. Der Fluss ergibt sich somit zu:
Für einfache Anwendungsfälle kann anstelle des chemischen Potenzials die Konzentration c verwendet werden. Diese ist einfacher zugänglich als das chemische Potenzial eines Stoffes. Bei sehr geringen Konzentrationen (einzelne Moleküle) ist diese Betrachtung nicht mehr ohne Weiteres zulässig, da die klassische Thermodynamik Lösungen als Kontinuum betrachtet. Bei hohen Konzentrationen beeinflussen sich die Teilchen gegenseitig, so dass bei anziehender Wechselwirkung der Konzentrationsausgleich langsamer, bei abstoßender schneller erfolgt. Das chemische Potenzial ist in diesem Fall nicht mehr logarithmisch von der Konzentration abhängig. Erstes Fick'sches GesetzNach dem Ersten Fick'schen Gesetz ist die Teilchenstromdichte (Flux) J (mol m−2 s−1) proportional zum Konzentrationsgradienten entgegen der Diffusionsrichtung ∂c/∂x (mol·m−4). Die Proportionalitätskonstante ist der Diffusionskoeffizient D (m2 s−1). Die Teilchenstromdichte macht eine quantitative Aussage über die (im statistischen Mittel) gerichtete Bewegung von Teilchen, d. h. wie viele Teilchen einer Stoffmenge sich pro Zeiteinheit durch eine Flächeneinheit, die senkrecht zur Diffusionsrichtung liegt, netto bewegen. Die angegebene Gleichung gilt auch für den allgemeinen Fall, dass der Diffusionskoeffizient nicht konstant ist, sondern von der Konzentration abhängt (das ist aber streng genommen nicht mehr die Aussage des Ersten Fick'schen Gesetzes). Zweites Fick'sches Gesetz (Diffusionsgleichung)Kontinuitätsgleichung und Differentialgleichung für den eindimensionalen FallMit Hilfe der Kontinuitätsgleichung (Massenerhaltung) ergibt sich aus dem Ersten Fick'schen Gesetz die Diffusionsgleichung
Sie stellt eine Beziehung zwischen zeitlichen und örtlichen Konzentrationsunterschieden dar und eignet sich somit zur Darstellung instationärer Diffusion, im Gegensatz zum 1. Fick'schen Gesetz, das einen zeitlich konstanten Diffusionsfluss beschreibt. Es existieren für diese Differentialgleichung zahlreiche analytische und numerische Lösungsansätze, die jedoch stark von den Anfangs- und Randbedingungen abhängen. Eine mögliche Lösung ist im Artikel Wärmeleitungsgleichung angegeben. Differentialgleichung für den dreidimensionalen FallDer Fall der dreidimensionalen Diffusion lässt sich mit dem Zweiten Fick'schen Gesetz in seiner allgemeinsten Form beschreiben: mit dem Nabla-Operator Die Lösung dieser Gleichung ist in der Regel aufwändig und je nach betrachtetem Gebiet nur numerisch möglich. Im stationären Fall ergibt sich eine elliptische partielle Differentialgleichung. Wenn zusätzlich der Diffusionskoeffizient isotrop ist, erhält man eine Differentialgleichung vom Laplace-Typ. Arten von DiffusionEs ist üblich, vier Arten der Diffusion zu unterscheiden[2]. Die Diffusionskoeffizienten unterscheiden sich bei unterschiedlichen Diffusionsarten, auch wenn gleiche Teilchen unter Standardbedingungen diffundieren. Selbstdiffusion (engl.: self diffusion)Wenn in einem Gas oder einer Lösung kein makroskopischer Gradient existiert, findet außschließlich echte Selbstdiffusion statt. Selbstdiffusion ist der Transport von Teilchen in einer Lösung derselben Substanz, z. B. Natriumionen in einer NaCl-Lösung. Da dies so nicht beobachtet werden kann, nähert man Selbstdiffusion mit isotopischen Tracern desselben Stoffes an, z. B. 22Na+ für Natriumionen. Dabei geht man davon aus, dass der Gradient, der durch Zugabe des Tracers entsteht, vernachlässigbar klein ist. Selbstdiffusion ist ein Modell zur Beschreibung der Brownschen Molekularbewegung. Die mittels Tracer bestimmten Diffusionskoeffizienten lassen sich über σ2 = 2D in die mittlere quadratische Verschiebung eines Teilchens pro Zeiteinheit umrechnen[3].Eine besonders vielseitige Methode zur Messung von Selbstdiffusions-Koeffizienten stellt die Feldgradienten-NMR dar. TracerdiffusionTracerdiffusion ist die Diffusion geringer Konzentrationen eines Stoffes in einer Lösung einer zweiten Substanz. Tracerdiffusion unterscheidet sich von der Selbstdiffusion dahingehend, dass ein markiertes Teilchen eines anderen Stoffes als Tracer benutzt wird, z. B. 42K+ in NaCl-Lösung. Häufig werden radioaktiv oder fluoreszenzmarkierte Tracer verwendet, da man diese sehr gut detektieren kann. Bei unendlicher Verdünnung sind die Diffusionskoeffizienten von Selbst- und Tracerdiffusion identisch.Klassische Ficksche DiffusionDies bezeichnet die Diffusion entlang eines relativ starken Gradienten. Bei dieser Art der Diffusion ist eine Approximation des Diffusionskoeffizienten am besten möglich.Gegendiffusion (engl.: counter diffusion)Gegendiffusion tritt auf, wenn entgegengesetzte Gradienten vorhanden sind, so dass Teilchen in entgegengesetzte Richtungen diffundieren.Diffusion von GasenPrinzipiell unterscheidet sich die Diffusion von Teilchen in Gasen hinsichtlich ihrer Gesetzmäßigkeiten nicht von der Diffusion gelöster Teilchen in Flüssigkeiten. Allerdings ist die Geschwindigkeit der Diffusion (bei vergleichbaren Gradienten) hier um Größenordnungen höher, da auch die Bewegung einzelner Teilchen in Gasen erheblich schneller ist. Die Diffusion verdünnter Gase in Multikomponentensystemen lässt sich mit dem Modell der Maxwell-Stefan-Diffusion beschreiben. Diffusion in FestkörpernIn einem perfekten Kristallgitter schwingt jedes Gitterteilchen um seinen festen Gitterplatz, kann diesen aber nicht verlassen. Eine notwendige Voraussetzung für Diffusion in einem kristallinen Festkörper ist daher das Vorliegen von Fehlern im Gitter. Nur durch Gitterfehler können Platzwechsel von Atomen oder Ionen als Bedingung für Stofftransport stattfinden. Es sind verschiedene Mechanismen denkbar[4]:
Auch die Diffusion in Kristallen lässt sich durch die Fickschen Gesetze beschreiben. Allerdings können Diffusionskoeffizienten hier von der Raumrichtung abhängen (Anisotropie). Die im isotropen Fall skalaren Diffusionskoeffizienten werden dann zu einem Tensor zweiter Stufe. Die Diffusion in nichtkristallinen (amorphen) Festkörpern ähnelt in mechanistischer Hinsicht der in Kristallen, wobei allerdings die Unterscheidung zwischen regulären und irregulären Gitterplätzen entfällt. Mathematisch können solche Prozesse gut wie die Diffusion in Flüssigkeiten beschrieben werden. Fokker-Planck-GleichungEine zusätzliche Kraft durch ein vorhandenes Potenzial führt dazu, dass die Gleichverteilung nicht mehr dem stationären Zustand entspricht. Die Theorie dazu liefert die Fokker-Planck-Gleichung. Sonderfall: Erleichterte Diffusion (Biologie)Die erleichterte Diffusion oder Permeabilität beschreibt in der Biologie die Möglichkeit für bestimmte Stoffe, eine Biomembran leichter zu durchdringen als dies eigentlich aufgrund ihrer Größe, Ladung, Polarität etc. möglich wäre. Bestimmte Proteine, sogenannte Tunnelproteine, bilden einen Tunnel durch die Zellmembran, der durch seinen Durchmesser und/oder Ladungsverteilungen bestimmte Stoffe leichter passieren lässt als durch die „geschlossene“ Membran (etwa Ionenkanäle). Geschichte der DiffusionsforschungEiner der Ersten, die systematisch Diffusionsversuche in größerem Umfang durchführten, war Thomas Graham. Aus seinen Experimenten zur Diffusion von Gasen leitete er das nach ihm benannte Graham'sche Gesetz ab:
In Hinblick auf Diffusion in Lösungen konnte Graham zeigen, dass die Diffusionsrate proportional zu Konzentrationsdifferenz und abhängig von der Temperatur ist (schnellere Diffusion bei höheren Temperaturen).[7] Weiterhin zeigte Graham die Möglichkeit auf, Mischungen von Lösungen oder Gasen mittels Diffusion zu trennen.[5][7] Thomas Graham hatte die grundlegenden Gesetze der Diffusion noch nicht ermitteln können. Dies gelang nur wenige Jahre später Adolf Fick. Er postulierte, dass das gesuchte Gesetz analog zu den Gesetzmäßigkeiten der Wärmeleitung, die Jean Baptiste Joseph Fourier ermittelt hatte, sein müsse: „Die Verbreitung eines gelösten Körpers im Lösungsmittel geht, wofern sie ungestört unter dem ausschließlichen Einfluß der Molecularkräfte stattfindet, nach demselben Gesetze vor sich, welches Fourier für die Verbreitung der Wärme in einem Leiter aufgestellt hat, und welches Ohm bereits mit so glänzendem Erfolge auf die Verbreiterung der Elektricität (wo es freilich bekanntlich nicht streng richtig ist) übertragen hat.“[8] Fick führte Experimente durch, deren Ergebnisse die Gültigkeit des später nach ihm benannten Ersten Fick'schen Gesetzes belegten. Die Gültigkeit des Zweiten Fick'schen Gesetzes konnte er nur aus der Gültigkeit des Ersten herleiten. Der direkte Nachweis scheiterte an seinen begrenzten analytischen und mathematischen Möglichkeiten. Albert Einstein gelang es Anfang des 20. Jahrhunderts, die Fick'schen Gesetze aus den Gesetzen der Thermodynamik abzuleiten und so der Diffusion ein sicheres theoretisches Fundament zu geben.[3] Dabei leitete er auch die Stokes-Einstein-Beziehung zur Berechnung des Diffusionskoeffizienten her: „Der Diffusionskoeffizient der suspendierten Substanz hängt also außer von universellen Konstanten und der absoluten Temperatur nur vom Reibungskoeffizienten der Flüssigkeit und von der Größe der suspendierten Teilchen ab.“ Anwendungen
Falsche Wortanwendung von DiffusionHäufig wird das Wort Diffusion fälschlicherweise für das deutsche Wort Diffusität verwendet. Dies ist durch falsche Übersetzungen aus dem Englischen auf dem Gebiet der Akustik begründet. Literatur
Einzelnachweise
Siehe auch
Kategorien: Lesenswert | Physikalische Chemie |
||
| Dieser Artikel basiert auf dem Artikel Diffusion aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





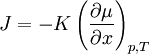
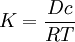
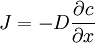
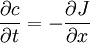
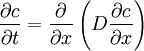 bzw., für konstante Diffusionskoeffizienten,
bzw., für konstante Diffusionskoeffizienten, 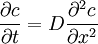 .
.
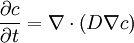
 . Die Form dieser parabolischen partiellen Differentialgleichung ist die der Wärmeleitungsgleichung.
. Die Form dieser parabolischen partiellen Differentialgleichung ist die der Wärmeleitungsgleichung.