Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Landolt-ReaktionAls Landolt-Reaktion bezeichnet man die zeitlich verzögerte Bildung von Iod aus Iodsäure und schwefliger Säure.
Produkt-HighlightBei Zugabe von Stärke führt das entstehende Iod zu einer Blaufärbung der Lösung (Iodprobe). Eine relative Bekanntheit erlangte diese Reaktion, weil unter bestimmten Bedingungen die Blaufärbung nicht schlagartig auftritt, sondern erst nach einer längeren Zeitphase nach dem Mischen der Edukte. Aus diesem Grund wird die Landolt-Reaktion auch Landoltsche Zeitreaktion oder Ioduhr genannt und häufig bei Schauversuchen zur Einführung in die Chemie und chemische Kinetik vorgestellt. Chemische GrundlagenReaktionsgleichung (1) beschreibt lediglich den Gesamtumsatz, nicht jedoch die Teilreaktionen, die mit unterschiedlichen Reaktionsgeschwindigkeiten ablaufen und zu einer verzögerten Iodbildung führen. Als Edukte verwendet man im allgemeinen nicht direkt die Säuren, sondern ihre Salze, Iodate bzw. Sulfite oder Hydrogensulfite, in saurer Lösung. Die relevanten Teilreaktionen sind aber immer dieselben: Iodat und Sulfit bilden in einer Redoxreaktion Iodid-Ionen.
Iodid und Iodat reagieren in einer Komproportionierung zu Iod
das jedoch sofort wieder zu Iodid reduziert wird, solange in der Lösung noch Sulfit vorliegt.
Reaktion (4) ist so schnell, dass in der Lösung praktisch kein Iod vorhanden ist. Erst wenn das Sulfit infolge der Reaktionen (2) und (4) verbraucht ist, kommt es zur Bildung einer nachweisbaren Menge Iods, das mit überschüssigem Iodid Polyiodid bildet.
I5- wird in den linearen Helixkanälen der Amylose in Stärke stabilisiert und erscheint blau. HistorischesDie Reaktion ist nach dem schweizer Chemiker Hans Heinrich Landolt benannt, der im Jahr 1886 erstmals ausführliche Versuche beschrieb [1]. Er ermittelte auch eine Gleichung zur Berechnung der Zeit vom Mischen der Edukte bis zum Farbumschlag der Lösung [2]. Darin sind T der Zahlenwert der Temperatur in °C, CS der Zahlenwert der Konzentration der schwefligen Säure und CJ der Zahlenwert der Konzentration der Iodsäure, jeweils in g m-3. Diese Gleichung ist empirisch und besitzt nur Gültigkeit im Temperaturbereich 5°C bis 40°C, Literatur
|
| Dieser Artikel basiert auf dem Artikel Landolt-Reaktion aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





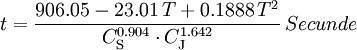
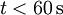 und
und 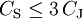 . Landolt diskutierte in [2] außerdem andere Faktoren, deren Einfluss auf die Zeit bis zum Farbumschlag nicht unmittelbar aus den Reaktionsgleichungen hervor geht, aber eindeutig vorhanden ist, darunter Schwefelsäure, verschiedene andere Säuren, Natriumchlorid ("Chlornatrium") und Wand der Reaktionsgefäße.
. Landolt diskutierte in [2] außerdem andere Faktoren, deren Einfluss auf die Zeit bis zum Farbumschlag nicht unmittelbar aus den Reaktionsgleichungen hervor geht, aber eindeutig vorhanden ist, darunter Schwefelsäure, verschiedene andere Säuren, Natriumchlorid ("Chlornatrium") und Wand der Reaktionsgefäße.


