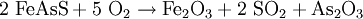Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Arsen(III)-oxid
Arsen(III)-oxid, As2O3, auch Diarsentrioxid, Arsenik oder (ungenau) Arsentrioxid ist das Anhydrid der in freiem Zustand nicht vorkommenden arsenigen Säure (H3AsO3). Technisch ist es die wichtigste chemische Verbindung des Arsens. Produkt-Highlight
GeschichteArsenik ist seit langem als Mordgift berüchtigt. Seit der Spätantike war es das mit Abstand am meisten verwendete Gift. Unter anderem wurde es von den Borgia-Päpsten zur Beseitigung in Ungnade gefallener Kardinäle benutzt. Die Familie Borgia hatte sogar ein auf Arsenik aufbauendes „Rezept“ entwickelt: Sie lagerten Arsenik mehrere Monate im Magen eines geschlachteten Schweines. Die Einzelheiten des Verfahrens sind bis heute nicht bekannt. Die Bezeichnung „Erbschaftspulver“ für Arsenik deutet ebenso auf die gezielte Verwendung als Gift hin. In alten lateinischen Texten wird ein Mordanschlag auf einen Fürsten, wenn man Blutvergießen vermeiden wollte, als coniuratio pulveraria, d. h. „eine Verschwörung mit Giftpulver“, bezeichnet (siehe Johannes Fecht, Historia colloquii Emmendingensis, S. 372, Rostock 1694). Ein solcher Anschlag wurde 1590 auf Markgraf Jakob III. verübt. Jahrhundertelang ließ sich Arsenik chemisch nicht nachweisen. Wenn der Mörder die seit dem 16. Jahrhundert bekannte, richtige Dosis verwendete, war ihm der Mord kaum zu beweisen. Noch um 1840 waren 90 bis 95 Prozent aller Giftmorde auf den Einsatz von Arsenik zurückzuführen. Nach Einführung der Marshschen Probe 1836 nahmen die Mordanschläge mit Arsenik allmählich ab. In der römischen Antike wurde Arsenik auch als Mittel zur Depilation von Schamhaar benutzt. VorkommenArsentrioxid entsteht bei der Verbrennung von elementarem Arsen an der Luft. In mineralischer Form kommt Arsenik als kubischer Arsenolith (Arsenikblüte) sowie als monokliner Claudetit vor. Gewinnung und DarstellungTechnisch gewinnt man Arsentrioxid durch das Rösten arsenhaltiger Erze in so genannten Gifthütten. Das Arsentrioxid entweicht dabei als flüchtiger Hüttenrauch. In langen Kanälen (Giftfängen) verdichtet sich das Gas zu einem weißen Pulver. Die Reinigung des Rohproduktes erfolgt durch Sublimation. Je nach Kondensationstemperatur erhält man ein weißes Pulver, das als Giftmehl bezeichnet wird, oder das farblose, glasartige Arsenikglas. EigenschaftenArsentrioxid ist pulverförmig, weißlich und wird wie Kochsalz farblos, wenn es feucht wird. Es ist geruchsfrei. Die Standardbildungsenthalpie (ΔfH0l) hat einen Wert von - 657,41 kJ/mol. VerwendungArsentrioxid wird zur Herstellung von Giften für Nagetiere und Insekten ebenso genutzt wie für die Konservierung von Fellen und Häuten. In der Glasherstellung nutzt man es zum Läutern und Entfärben der Schmelze. Daneben ist Arsentrioxid bereits seit der Antike als wirksames Mittel bei Blutkrankheiten bekannt. In Europa hat es heute den Status eines Orphan-Arzneimittels (Handelsname Trisenox®) und wird zur Behandlung der akuten Promyelozytenleukämie (APL), einer Unterform der akuten myeloischen Leukämie, eingesetzt.[3] Weiterhin wird es hochpotenziert als Arsenicum album in der Homöopathie verwendet. Arsentrioxid ist eine Urtitersubstanz nach Arzneibuch. SicherheitshinweiseToxizitätArsentrioxid ist ein starkes Gift und eindeutig krebserregend. Beim Menschen vermag es bösartige Geschwulste zu verursachen. Oral aufgenommen können bereits weniger als 0,1 g tödlich sein. Akute Vergiftungen äußern sich nach wenigen Stunden durch massive Durchfälle und Erbrechen. Starke Schmerzen kommen hinzu, zunächst im Magen-Darm-Bereich, später, nach einer Scheinbesserung, treten in den Extremitäten Krämpfe auf. Die körperliche Schwäche nimmt beständig zu, Bewusstseinstrübungen, Sehstörungen und langsames Erkalten bereits einen Tag vor Eintritt des Todes werden registriert. Bei der Obduktion findet man u. a. erbsen- bis bohnengroße Magenerosionen an der Magenhinterwand, wo die Giftkristalle an der Schleimhaut haften geblieben waren. Um Unfällen vorzubeugen, ist beim Hantieren mit dieser Verbindung unter einem Abzug zu arbeiten. Als Gegenmaßnahme bei Vergiftungen ist der Mund auszuspülen, Erbrechen auszulösen (nicht bei bewusstlosen Personen) und sofort ein Arzt zu benachrichtigen. In Unfallsituationen sollte ein gasdichter Ganzkörperanzug getragen werden. Trotz der hohen Giftigkeit wurde Arsenik im 19. Jahrhundert von Arsenikessern auch als Stimulans gebraucht. Die sich dabei herausbildende Toleranz beruht nicht auf einer Gewöhnung des Körpers an Arsentrioxid, sondern allein auf der verminderten Resorption durch die Magenschleimhaut. NachweisDas in Arsentrioxid enthaltene Arsen lässt sich mit Hilfe der Marsh'schen Probe nachweisen. Quellen
Kategorien: Giftiger Stoff | Umweltgefährlicher Stoff | Arsenverbindung | Oxid | Arzneistoff |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Arsen(III)-oxid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||