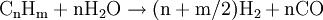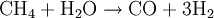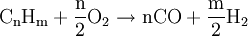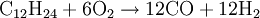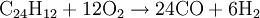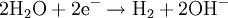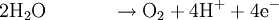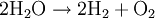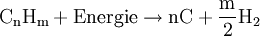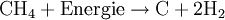Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
WasserstoffherstellungUm Wasserstoff verwenden zu können, bedarf es erst der Herstellung aus anderen Energieträgern. Es gibt bei der Wasserstoffherstellung einige bereits bekannte Verfahren aus der Chemieindustrie und neuere, die speziell für die Brennstoffzelle entwickelt wurden. Dabei hat jede Möglichkeit ihre Vor- und Nachteile, so dass weitere Forschungsarbeiten nötig sind, um diese zu optimieren und marktfähig zu machen. Produkt-HighlightHerstellungsverfahrenEs werden nachfolgend einige aktuell gebräuchliche Verfahren zur Herstellung von Wasserstoff erläutert. DampfreformierungBei diesem Verfahren werden Kohlenwasserstoffe, die in der Natur - z. B. in Biomasse - häufig auftreten und in Form von Erdgasen wie Methan bereits für andere Energiegewinnungsverfahren genutzt werden, aber auch langkettigere Kohlenwasserstoffe der Mittelbenzinfraktion, in zwei Prozessen vom Wasserstoff getrennt. Diese Art der Wasserstoffgewinnung ist bereits lange erprobt und ausgereift, so dass bereits große Anlagen mit einer Kapazität von 100.000 m³/h vorhanden sind. Im ersten Schritt werden langkettigere Kohlenwasserstoffe in einem Pre-Reformer unter Zugabe von Wasserdampf bei einer Temperatur von etwa 450-500 °C und einem Druck von etwa 25-30 bar zu Methan, Wasserstoff, Kohlenmonoxid sowie Kohlendioxid aufgespalten, um eine zu starke Verkokung des Reformerkatalysators zu vermeiden. Im zweiten Schritt wird im Reformer das Methan bei einer Temperatur von 800 bis 900 °C und einem Druck von etwa 25-30 bar an einem Nickelkatalysator mit Wasser zur Reaktion gebracht. Anzumerken ist, dass diese Katalysatoren äußerst empfindlich auf Schwefel- und Halogenverbindungen, insbesondere Chlor, reagieren, weshalb in der Praxis in der Regel eine Raffinationsanlage vorgeschaltet wird.
Das durch unvollständige Umsetzung erzeugte Kohlenmonoxid wird anschließend noch mit Hilfe der Wassergas-Shift-Reaktion an einem Eisen(III)-oxidkatalysator zu Kohlendioxid und Wasserstoff umgesetzt. Um im abschließendem Schritt Reinstwasserstoff zu gewinnen, nutzt man in der Praxis häufig Druckwechseladsorbtionsanlagen oder Lauge-Absorbtionsgaswäschen, die Nebenprodukte wie CO, CO2 und CH4 bis auf einige wenige ppm herausfiltern. Partielle OxidationDie Partielle Oxiadation ist technisch bereits sehr ausgereift. Dabei wird Erdgas oder ein schwerer Kohlenwasserstoff (Heizöl) in einem exothermen Prozess mit Sauerstoff versetzt.
Die angegebenen Formeln für Kohle und Heizöl zeigen nur jeweils einen typischen Vertreter aus diesen hochkomplexen Stoffgemischen. Meist wird noch Wasser zugesetzt, um sowohl die extremen Temperaturen als auch die Rußbildung in den Griff zu bekommen, sodass man von einer autothermen Reformierung mit wenig Wasser sprechen müsste. In kohlereichen Ländern wie China oder Südafrika kann als Ausgangsstoff für dieses Verfahren auch Kohle genutzt werden, die vorher zermahlen und mit Wasser zu einer Suspension vermischt wird. Autotherme ReformierungDiese Art der Reformierung ist eine Kombination der Dampfreformierung und der partiellen Oxidation, um den Wirkungsgrad zu optimieren. Dabei kann beispielsweise Methanol wie auch jeder andere Kohlenwasserstoff beziehungsweise jedes Kohlenwasserstoffgemisch (Erdgas, Benzin, Diesel u.s.w.) verwendet werden. Dabei werden die beiden Verfahren so miteinander kombiniert, dass der Vorteil der Oxidation (Bereitstellung von Wärmeenergie) sich mit dem Vorteil der Dampfreformierung (höhere Wasserstoffausbeute) optimierend ergänzt. Dies geschieht durch genaue Dosierung der Luft- und Wasserdampfzufuhr. An die hier eingesetzten Katalysatoren werden besonders hohe Ansprüche gestellt, da sie sowohl die Dampfreformierung mit der Wassergas-Shift-Reaktion als auch die partielle Oxidation begünstigen müssen. GasaufarbeitungNach der Reformierung wird das Synthese-Gas weiter aufgearbeitet. Es folgt in einem nächsten Schritt die CO-Konvertierung mittels der Wassergas-Shift-Reaktion. Gefolgt von einer gegebenenfalls erforderlichen CO-Fein-Reinigung mittels preferentieller Oxidation oder Selektiver Methanisierung chemisch umgesetzt oder physikalisch durch Druckwechseladsorption oder eine wasserstoffpermeablen Membran aus einer Palladium-Silber-Legierung (PdAg) abgetrennt. Großtechnisch besteht auch die Möglichkeit CO2 mit flüssigem Methan auszuwaschen. Elektrolyse von WasserDiese Form der Umwandlung von Wasser zu Wasserstoff wurde erstmals um 1800 vom deutschen Chemiker Johann Wilhelm Ritter nachgewiesen, und ist wahrscheinlich auf lange Sicht die einzige sinnvolle Variante, da kein CO2 freigesetzt wird. Als Beispiel dafür gilt besonders die alkalische Elektrolyse, die durch niedrige Strompreise und häufige Kombination mit Wasserkraftwerken vor allem in Norwegen und Island genutzt wird. Die Reaktion findet in einem mit leitfähigem Elektrolyten (Salze, Säuren, Basen) gefüllten Gefäß statt, in dem sich zwei Elektroden befinden, die mit Gleichstrom betrieben werden. Der Herstellungsprozess läuft dabei in zwei Teilreaktionen ab.
An der Anode werden im Prinzip Elektronen abgegeben und von der Kathode wieder aufgenommen. Diese zwei Teilprozesse ergeben zusammengefasst eine Gesamtreaktion, bei der der „Spaltungsprozess“ sichtbar wird, das heißt, dass Wasser in seine zwei Bestandteile Sauerstoff und Wasserstoff zerlegt wird.
Das Verfahren ist besonders günstig, da auch der erzeugte reine Sauerstoff energiewirtschaftlich sinnvoll verwendet werden kann und nicht einfach an die Luft abgegeben wird. BiomasseGrundsätzlich handelt es sich bei Biomasse um einen Kohlenwasserstoff, den man mit allothermer oder autothermer Dampfreformierung in Wasserstoff umwandeln kann. Da Biomasse zu ca. 40% aus organisch gebundenem Sauerstoff besteht, vergast Biomasse fast von alleine. Man braucht also nur sehr wenig zusätzlichen Sauerstoff, um die endotherme Reaktion durchzuführen. Man erreicht daher deutlich höhere Wirkungsgrade als beispielsweise bei der Vergasung von Kohle. Die großtechnische Vergasung von Biomasse ist mit 2,5 ct/kWh nach Tetzlaff das derzeit (2006) kostengünstigste Verfahren zur Herstellung von Wasserstoff. Ein weiteres Verfahren ist die Verbindung von Pyrolyse und Vergasung von Biomasse. Die erste Stufe bei der Herstellung ist hierbei die Pyrolyse, bei der als Endprodukte Primärgase (Erdgase), Koks und Methanol entstehen. Diese werden in einem zweiten Teilprozess mit Wasserdampf versetzt und es entsteht wiederum ein Gemisch aus Wasserstoff, Methan, Kohlenmonoxid und -dioxid. Auch bei diesem zweiten Schritt muss Energie zugeführt werden und es wird anschließend durch Dampfreformierung Wasserstoff gewonnen. Diese zweistufige Variante wird vor allem für kleinere Anlagen eingesetzt. Bei Verwendung von Biomasse mit hohem Feuchtigkeitsanteil, beispielsweise Biomüll von Haushalten, kann durch Methangärung 60-70%iges Methan erzeugt werden. Das entspricht dem Biogas aus Gülle. Nach der Entschwefelung kann Biogas in Hochtemperaturbrennstoffzellen vom Typ MCFC oder SOFC direkt als Brenngas verwendet werden, wobei allerdings immer noch in einigem Umfang umweltbelastendes CO2 abgegeben wird. Für die preiswerteren und einfacher (ohne Reformer-Einheit) gebauten Niedertemperatur-Brennstoffzellen wie PEMFC ist Wasserstoff mit einem bestimmten Reinheitsgrad erforderlich. Dazu scheint es zweckmäßig, die Gasversorgung auf Wasserstoff umzustellen, um die Nachfrage nach PEMFCs anzuregen und mit Markteinführungshilfen - etwa nach dem Vorbild des 100.000-Dächer-Programms in der Photovoltaik - die kostengünstige Großserienherstellung von PEMFCs für die Energieversorgung (Wärme und Strom) der Endverbrauchsstellen einzuleiten. An den Orten der Wasserstoffherstellung könnte klimaschädliches Kohlendioxyd abgeschieden und einer klimaentlastenden Endlagerung zugeführt werden. Unter anaeroben Bedingungen kann Wasserstoff durch Mikroorganismen direkt aus Biomasse gewonnen werden. Werden hierfür Mischkulturen verwendet, muss die Wasserstoffproduktion vom letzten Glied der anaeroben Nahrungskette, der Methanproduktion, entkoppelt werden. Da die Freisetzung von molekularem Wasserstoff für Mikroorganismen aus Gründen der Reaktionskinetik nur bei sehr niedrigem Wasserstoffpartialdruck begünstigt wird, ist es die Aufgabe von Bioreaktoraufbau und -betrieb den Partialdruck des Wasserstoffs trotz Abwesenheit methanogener Bakterien oder Sulfat reduzierenden Bakterien (also: Wasserstoff verwertender Bakterien) niedrig zu halten. Die fermentative Wasserstoffproduktion ist jedoch energetisch ungünstig. Nach Thauer (1976) können auf dem beschriebenen Weg maximal 33% der Verbrennungswärme aus Glucose in Wasserstoff gespeichert werden. Im Vergleich dazu können durch Methangärung 85% der Verbrennungswärme aus Glucose in das Gärprodukt überführt werden. Kværner-VerfahrenDas in Norwegen entwickelte Verfahren trennt Kohlenwasserstoffe in einem Plasmabrenner bei 1600 °C vollständig in Aktivkohle (reinen Kohlenstoff) und Wasserstoff.
Eine 1992 in Kanada erbaute Pilotanlage erreichte nahezu einen Wirkungsgrad von 100 %, wovon etwa 48 % in Wasserstoff, etwa 40 % in Aktivkohle und etwa 10 % in Heißdampf übergehen. Thermochemische VerfahrenDie thermische Dissoziation bezeichnet den Zerfall von Molekülen durch Wärme-Einwirkung in seine einzelnen Atome. Oberhalb einer Temperatur von 1.700 °C vollzieht sich die direkte Spaltung von Wasserdampf in Wasserstoff und Sauerstoff. Dies geschieht zum Beispiel in Solaröfen. Die entstehenden Gase können mit keramischen Membranen voneinander getrennt werden. Diese Membranen müssen für Wasserstoff, jedoch nicht für Sauerstoff durchlässig sein. Das Problem dabei ist, dass sehr hohe Temperaturen auftreten und nur teure, hitzebeständige Materialien dafür in Frage kommen. Aus diesem Grund ist dieses Verfahren nach wie vor nicht konkurrenzfähig. Eine Absenkung der Temperatur der thermischen Wasserspaltung auf unter 900 °C kann über gekoppelte chemische Reaktionen erreicht werden. Bereits in den 70er Jahren wurden für die Einkopplung der Wärme von Hochtemperaturreaktoren verschiedene thermochemische Kreisprozesse vorgeschlagen, die zum Teil auch für die Nutzung konzentrierter Solarstrahlung geeignet sind. Die höchsten Systemwirkungsgrade sowie das größte Potenzial für Verbesserungen weist aus heutiger Sicht ein verbesserter Schwefelsäure-Iod-Prozess auf: Iod und Schwefeldioxid reagieren bei 120 °C mit Wasser zu Iodwasserstoff und Schwefelsäure. Nach der Separation der Reaktionsprodukte wird Schwefelsäure bei 850 °C in Sauerstoff und Schwefeldioxid gespalten, aus Iodwasserstoff entsteht bei 300 °C Wasserstoff und das Ausgangsprodukt Iod. Den hohen thermischen Wirkungsgraden der thermochemischen Kreisprozesse (bis zu 50 %) müssen die heute noch weitgehend ungelösten material- und verfahrenstechnischen Schwierigkeiten gegenübergestellt werden. Photochemische HerstellungDer Grundgedanke besteht darin, die Solarstrahlung direkt zu nutzen, indem energiereiche Photonen von Reaktanden absorbiert werden. Hierzu sind Halbleitermaterialien notwendig, deren Energielücke so groß ist, dass durch die Aufnahme von Lichtquanten dem Wasser Elektronen entzogen werden können, was zur Wasserspaltung führt. Durch den Einsatz von Photokatalysatoren sollen die dabei angeregten Umwandlungsprozesse erleichtert bzw. ermöglicht werden. Das Hauptproblem liegt darin, dass die photoaktiven Materialien katalytisch hochaktiv und gleichzeitig im Kontakt mit Wasser langfristig stabil sein müssen. Langfristig erscheint auch die Kombination von photo- und thermochemischen Verfahren Erfolg versprechend. Photobiologische HerstellungEs handelt sich hierbei um einen biologischen Prozess, der Sonnenlicht als Energiequelle nutzt. Das Verfahren ist unter Biowasserstoff und Wasserstoffbioreaktor genauer beschrieben. Wasserstofferzeugung auf Basis alternativer EnergiequellenDie umweltfreundlichste Art der Wasserstofferzeugung verwendet alternative Energiequellen (z.B. Sonnenlicht, Wind- und Wasserkraft) zur Spaltung von Wasser in Wasserstoff und Sauerstoff. Dabei wird wiederum zwischen thermischer und chemischer Umwandlung unterschieden. Erstere stellt eine relativ alte Idee dar, welche zunehmend Forschungsinteresse erfährt und gute Chance hat, in den nächsten Jahren konkurrenzfähig zu werden. Der Schwerpunkt der Forschung liegt dabei auf der Entwicklung geeigneter Katalysatoren für die thermische Spaltung des Wassers in Brennspiegelsystemen. Aber auch die Forschung in der Nanotechnologie lässt neue Verbundstoffe entstehen, welche sich für die Produktion von neuartigen "Tandem-Zellen" eignen. Bei der chemischen Umwandlung wird der aus alternativen Energiequellen gewonnene Strom direkt zur Elektrolyse des Wassers (siehe oben) verwendet und somit in eine speicherbare Form übergeführt. Außer Sauerstoff fallen hierbei keine weiteren Nebenprodukte an, was sehr umweltfreundlich ist. Siehe auch
|
| Dieser Artikel basiert auf dem Artikel Wasserstoffherstellung aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |