Rätsel um Katalyse zur grünen Produktion von Methanol aus Kohlendioxid gelöst
Live-Blick in die Synthese von Methanol
Anzeigen
Einem internationalen Forschungsteam unter Leitung von Wissenschaftlern der Universität Stockholm ist es erstmals gelungen, die Oberfläche eines Kupfer-Zink-Katalysators bei der Reduktion von Kohlendioxid zu Methanol zu beobachten. Die Erkenntnisse, die an DESYs Forschungslichtquelle PETRA III erzielt wurden, hat die Gruppe jetzt in der Fachzeitschrift Science veröffentlicht. Eine bessere Kenntnis des katalytischen Prozesses der Methanolsynthese und die Möglichkeit, noch effizientere Materialien hierfür zu finden, ist eine wichtige Grundlage für mehr Nachhaltigkeit in der chemischen Industrie.
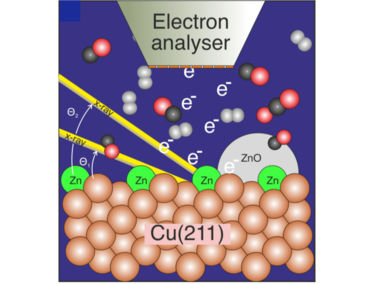
Bild für Insider: Die Grafik zeigt eine mit einer geringen Menge Zink bedeckte Kupferoberfläche des Katalysators, die während der Reaktion von Kohlendioxid, Kohlenmonoxid und Wasserstoff zu Methanol mit Hilfe der Photoelektronenspektroskopie untersucht wurde.
Stockholm University
Mit einer Jahresproduktion von 110 Millionen Tonnen ist Methanol einer der wichtigsten Grundstoffe in der Petrochemie. Es kann zu Zehntausenden verschiedenen Produkten weiterverarbeitet werden, z.B. zu Kunststoffen, Waschmitteln, Arzneimitteln und Kraftstoffen. Insbesondere als grüner Flugkraftstoff hat Methanol das Potenzial zu einem wichtigen Energieträger der Zukunft zu werden. Dieser könnte klimaneutral aus Kohlendioxid, das aus der Luft abgeschieden wird, und grünem Wasserstoff aus der Elektrolyse von Wasser, erzeugt werden. Eine zukünftige grüne Transformation der chemischen Industrie, bei der Wind- oder Sonnenenergie Elektrolysezellen antreiben, wird dadurch greifbar.
Methanol ist der am einfachsten aufgebaute Vertreter aus der Stoffgruppe der Alkohole. Die industrielle Herstellung von Methanol erfolgt in einem katalytischen Prozess, bei dem eine Mischung aus Kohlenmonoxid (CO), Kohlendioxid (CO2) und Wasserstoff (H2) zu Methanol (CH3OH) reagiert. Der Katalysator, der die Reaktion ermöglicht, besteht aus Kupfer, Zinkoxid und Aluminiumoxid. Die zugrundeliegende Funktion und der chemische Zustand der Katalysatorbestandteile während der Reaktion blieben jedoch stets ein Rätsel – bis jetzt.
„Die Herausforderung war, die Katalysatoroberfläche mit oberflächensensitiven Methoden unter realen Reaktionsbedingungen bei relativ hohen Drücken und Temperaturen experimentell zu untersuchen. Diese Bedingungen waren viele Jahre lang nicht erreichbar, und es gab verschiedene Hypothesen darüber, ob Zink während der Katalyse als Oxid, metallisch oder in einer Legierung mit Kupfer vorliegt, die aber nicht eindeutig verifiziert werden konnten“, sagt Anders Nilsson, Professor für chemische Physik an der Universität Stockholm.
„Es ist fantastisch, dass wir nach vielen Jahren intensiver Arbeit Licht in dieses komplexe Thema der Methanolbildung über Kupfer-Zink-Katalysatoren bringen konnten“, sagt Peter Amann, Erstautor der Veröffentlichung.
Die Untersuchungen führte das Team an der PETRA III-Beamline P22 durch, die auf die Untersuchung der elektronischen und atomaren Struktur von Oberflächen, Grenzflächen und Festkörpern mit Hilfe der Photoelektronenspektroskopie spezialisiert ist. „Das Besondere ist, dass wir in Stockholm ein Instrument für die Photoelektronenspektroskopie gebaut haben, mit dem sich Katalysatoroberflächen unter hohem Druck untersuchen lassen, so dass wir direkt beobachten können, was bei der Reaktion passiert“, sagt David Degerman, Doktorand der Chemischen Physik an der Universität Stockholm. „Mit unserem neuen Instrument haben wir eine neue Tür zur Erforschung der Katalyse geöffnet.“
„Mit unseren Messungen konnten wir nachweisen, dass Zink direkt an der Oberfläche mit Kupfer legiert ist und dadurch spezielle atomare Stellen entstehen, an denen Methanol aus Kohlendioxid gebildet wird“, sagt Chris Goodwin, Forscher im Bereich Chemische Physik an der Universität Stockholm. „Bei industriellen Prozessen wird eine kleine Menge Kohlenmonoxid beigemischt, was die Bildung von Zinkoxid aus Kohlendioxid verhindert.“
„Das innovative Spektroskopie-Instrument der Universität Stockholm in Kombination mit den Strahlparametern von PETRA III ermöglicht nun In-Operando-Experimente an Katalysatoren bei zehnmal höheren Drücken als an anderen Synchrotronlichtquellen“, sagt Christoph Schlueter (DESY), Leiter der Strahlführung P22. „Unser Stockholmer Instrument an PETRA III, einer der hellsten Röntgenquellen der Welt zu haben, war entscheidend für die Durchführung der Studie“, ergänzt Patrick Lömker, Postdoc an der Universität Stockholm. „Für die Zukunft mit noch helleren Quellen versprechen wir uns noch mehr spannende Forschung, wenn die Maschine zu PETRA IV ausgebaut wird.“
In der Studie konnten die Forscher unterschiedliche Verhaltensweisen der Katalysatoroberfläche in Abhängigkeit vom CO- und CO2-Anteil im Gasgemisch feststellen – ein Ansatzpunkt für die Optimierung bestehender und die Suche nach neuen, besseren Katalysatoren. „Wir verfügen nun über die Mittel, um weitere Katalysatormaterialien zu erforschen, die sich besser für eine grüne Transformation der chemischen Industrie eignen, die heute noch vollständig auf fossilen Brennstoffen basiert und für 8 Prozent der weltweiten Kohlendioxidemissionen verantwortlich ist“, sagt Anders Nilsson.
Die Studie wurde von der Universität Stockholm in Zusammenarbeit mit der Universität Innsbruck und der Technischen Universität Wien, DESY und dem Fritz-Haber-Institut in Berlin durchgeführt.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!






























































