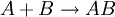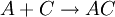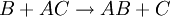Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Katalysator
Eigenschaften eines Katalysators:
Weitere Fachbegriffe zum Thema Katalysator: Katalyse, Autokatalyse, homogene Katalyse, heterogene Katalyse, Katalysatorgift und Biokatalysator. Weiteres empfehlenswertes Fachwissen
GeschichteVermutlich waren es die Assyrer vor über 5000 Jahren, die katalytische Prozesse erstmals bei der Gärung von Alkohol einsetzten. Seit der Antike werden chemische Reaktionen mit Hilfe von Katalysatoren ausgeführt. Erst Jöns Jakob Berzelius kam 1835 zu der Erkenntnis, dass eine Vielzahl von Reaktionen nur dann erfolgte, wenn ein bestimmter Stoff zugegen war, der jedoch nicht verbraucht wurde. Seiner Meinung nach wurden diese Stoffe nicht umgesetzt, lieferten jedoch durch ihre Anwesenheit die Energie über ihre katalytische Kraft. Er bezeichnete diese Stoffe als Katalysatoren. In der Folgezeit gelang es, tieferes Verständnis für die thermodynamischen Hintergründe der Katalyse zu gewinnen. Wilhelm Ostwald definierte den Katalysator 1895 wie folgt: „Ein Katalysator ist eine Substanz, die die Geschwindigkeit einer chemischen Reaktion verändert, ohne selbst in den Produkten zu erscheinen“[1] Für seine Arbeiten um die Katalyse erhielt Wilhelm Ostwald den Nobelpreis für Chemie. ChemieDie Wirkungsweise eines Katalysators beruht auf seiner Möglichkeit, den Mechanismus einer chemischen Reaktion derart zu verändern, dass die Aktivierungsenergie verändert wird. Man „geht einen anderen Weg“ auf der Potential-Hyperebene. Das Potential ist i. A. eine Funktion mehrerer Variablen. Deshalb ist im einfachsten Fall, nämlich der Abhängigkeit des Potentials von nur zwei Variablen, die sich ändern, das Potential eine 3-dimensionale Ebene. Die Variablen können z. B. zwei Bindungsabstände zwischen den Reaktanden sein, die sich während der Reaktion ändern. Dieser einfachste Fall ist zwar anschaulich, aber unrealistisch. Dieses geschieht über die Bildung einer reaktiven Zwischenverbindung und die weitere Abreaktion zu den Endprodukten, wobei der eingesetzte Katalysator zurückgebildet wird. In der Praxis werden allerdings Katalysatoren in der Regel durch Nebenreaktionen nach einiger Zeit des Gebrauchs unwirksam, da sie durch Nebenprodukte blockiert werden. Die folgende Grafik (Arrhenius-Diagramm) ergibt sich als Schnitt durch die Energie-Hyperpotentialfläche.
In der Grafik gibt die obere Kurve die Reaktion
wieder. Die Aktivierungsenergie wird mit AU bezeichnet. Die untere Kurve zeigt den Energieverlauf der durch C katalysierten Reaktion. Hier wird über einen Übergangszustand (1. Maximum) ein Minimum erreicht, welches der Enthalpie der Verbindung AC entspricht.
Über einen weiteren Übergangszustand wird das Produkt AB erreicht, wobei der Katalysator C zurückgebildet wird.
Die mit AC bezeichnete Aktivierungsenergie der katalysierten Reaktion ist deutlich geringer. Als Beispiel kann die katalytische Verbrennung von Wasserstoff mit Sauerstoff angeführt werden. Diese Verbrennung ist thermodynamisch so günstig, dass sie prinzipiell „freiwillig“ ablaufen sollte, jedoch aufgrund der bei Zimmertemperatur hohen Aktivierungsenergie so stark gehemmt ist, dass die Reaktionsgeschwindigkeit sehr gering ist. Die Anwesenheit eines Platinkatalysators kann diese Aktivierungsenergie derart erniedrigen, dass diese Reaktion dann hinreichend schnell auch bei niedrigeren Temperaturen abläuft. Eine Anwendung dafür war das Döbereinersche Feuerzeug. Bei Gleichgewichtsreaktionen verändert ein Katalysator Hin- und Rückreaktion auf die gleiche Weise, so dass die Lage des Gleichgewichts nicht verändert wird, das Gleichgewicht sich aber schneller einstellt. Bedeutung der KatalysatorenKatalysatoren kommen in der Natur in vielfältiger Weise vor. In Lebewesen laufen fast alle lebensnotwendigen chemischen Reaktionen katalysiert ab (z. B. bei der Photosynthese, der Atmung oder der Energiegewinnung aus der Nahrung). Die verwendeten Katalysatoren sind meist bestimmte Eiweiße, die Enzyme. Die Herabsetzung der Aktivierungsenergie durch positive Katalysatoren ist bei chemischen Reaktionen von großer (kommerzieller) Bedeutung. In mehr als 80 % aller chemischen industriellen Prozesse werden Katalysatoren eingesetzt. Ohne die Anwesenheit des Katalysators würde die jeweilige chemische Reaktion sehr viel langsamer oder gar nicht erfolgen. Deshalb sind Katalysatoren heutzutage kaum noch aus der Chemietechnik wegzudenken. Derzeit wird geschätzt, dass etwa 80 % aller chemischen Erzeugnisse eine katalytische Stufe in ihrer Wertschöpfungskette durchlaufen. Auch die negativen Katalysatoren haben in der chemischen Industrie eine gewisse Bedeutung erlangt, indem sie eingesetzt werden, wenn eine normalerweise explosionsartig verlaufende Reaktion industriell genutzt und kontrolliert werden soll (Beispiel: die Polymerisation von Metaldehyd aus Acetaldehyd) oder wenn ein bestimmtes Nebenprodukt ausgeschlossen werden soll. Auch im Bereich des Korrosionsschutzes werden Inhibitoren eingesetzt. Hierbei muss beachtet werden, dass Inhibitoren im Gegensatz zu den Katalysatoren nach der Reaktion verändert vorliegen können. Entstehen bei Reaktionen mehrere Produkte, spielt die Selektivität eines Katalysators eine sehr wichtige Rolle. Dabei wird der Katalysator so gewählt, dass nur diejenige Reaktion beschleunigt wird, die das erwünschte Produkt erzielt. Verunreinigungen durch Nebenprodukte werden so weitgehend vermieden. Aus der Sicht des Umweltschutzes wird durch den Einsatz von selektiven und aktiven Katalysatoren in der Regel Energie eingespart und die Menge an Nebenprodukten reduziert. Nicht minder bedeutsam für unsere Umwelt ist aber auch die Abgasnachbehandlung in der industriellen Produktion oder in Elektrizitätswerken. Im Falle der abgaskatalytischen Verfahren (z. B. in PKWs) werden unvermeidbare, gefährliche Substanzen in weniger gefährliche umgesetzt.
Beispiel: Im Autoabgaskatalysator reagiert das Atemgift Kohlenstoffmonoxid (CO) mit Sauerstoff (O2) zum Treibhausgas Kohlenstoffdioxid (CO2). Beispiele für KatalysatorenCereisen (Ammoniaksynthese), Raney-Nickel, Platin, Rhodium, Palladium, Vanadiumpentoxid und Samariumoxid katalysiert die Hydrierung und Dehydrierung von Ethanol. Hopcalite, eine Gruppe von Katalysatoren aus verschiedenen Metalloxiden, katalysieren die Oxidation von Kohlenstoffmonoxid zu Kohlenstoffdioxid bei Raumtemperatur. Fahrzeugkatalysator: Bekanntestes Beispiel ist der Katalysator im Automobil zur Reduktion der Abgasemission, bei dem das ganze Gerät nach dem chemisch wirksamen Prinzip benannt ist. Wichtige katalytische Verfahren
Literatur
Siehe auch
Fußnoten
Kategorien: Katalysator | Physikalische Chemie | Chemikaliengruppe |
||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Katalysator aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |