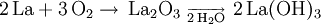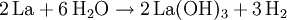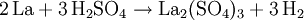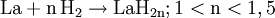Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Lanthan
Lanthan [lanˈtaːn] ist ein chemisches Element im Periodensystem der Elemente mit dem Symbol La und der Ordnungszahl 57. Lanthan gehört zur Gruppe der Lanthanoide (veraltet Lanthanide) ab, deren Namensgeber es ist. Das Element wird den Metallen der seltenen Erden zugeordnet. Produkt-Highlight
GeschichteLanthan (griechisch lanthanein „versteckt“) wurde 1839 von Carl Gustav Mosander entdeckt. Aus einem vermeintlich reinen Cernitrat gewann er durch fraktionierte Kristallisation Lanthansulfat. VorkommenLanthan kommt natürlich nur in chemischen Verbindungen vergesellschaftet mit anderen Lanthanoiden in verschiedenen Mineralien vor. Hauptsächlich sind dies: Gewinnung und DarstellungNach einer aufwändigen Abtrennung der anderen Lanthanbegleiter wird das Oxid mit Fluorwasserstoff zum Lanthanfluorid umgesetzt. Anschließend wird dieses mit Calcium unter Bildung von Calciumfluorid zum Lanthan reduziert. Die Abtrennung verbleibender Calciumreste und Verunreinigungen erfolgt in einer zusätzlichen Umschmelzung im Vakuum. Eigenschaften
Das silberweiß glänzende Metall ist hämmerbar und duktil. Es existieren drei metallische Modifikationen. Chemische EigenschaftenLanthan ist unedel. Es überzieht sich an der Luft rasch mit einer weißen Oxidschicht, die in feuchter Luft zum Hydroxid weiterreagiert.
Bei Temperaturen oberhalb von 440 °C verbrennt Lanthan zu Lanthanoxid (La2O3). Unter Bildung von Wasserstoff erfolgt in kaltem Wasser eine langsame, in warmen Wasser eine rasche Reaktion zum Hydroxid.
In verdünnten Säuren löst sich Lanthan unter Wasserstoffentwicklung auf.
Mit vielen Elementen reagiert es in der Wärme direkt, mit Halogenen schon bei Raumtemperatur. Lanthan und Wasserstoff bilden ein schwarzes, wasserempfindliches unstöchiometrisches Hydrid. VerwendungLanthan ist Bestandteil im Mischmetall. Pyrophore Werkstoffe für Zündsteine enthalten 25 bis 45 Gewichtsprozent Lanthan. Darüber hinaus findet es Verwendung als Reduktionsmittel in der Metallurgie. Als Gusseisenzusatz unterstützt es die Bildung von Kugelgraphit, als Legierungszusatz bewirkt es eine Verbesserung der Oxidationsbeständigkeit. Lanthanbeimengungen reduzieren die Härte und Temperaturempfindlichkeit von Molybdän. Katalysatoren zum Cracken von Petroleum und Benzin beinhalten zum Teil Lanthan. Die hierfür eingesetzten Mengen sind jedoch rückläufig. Hochwertige Kathoden zur Erzeugung von freien Elektronen bestehen aus Lanthanborid (LaB6) als Ersatz für Wolframdraht. Als Legierungsmetall:
Die Cobalt-Lanthan-Legierung LaCo5 wird als Magnetwerkstoff, lanthandotiertes Bariumtitanat zur Herstellung von Kaltleitern (temperaturabhängige Widerstände) verwendet. In Verbindung mit Cobalt, Eisen, Mangan, Strontium u. a. dient es als Kathode für Hochtemperatur-Brennstoffzellen (SOFC). „Verunreinigtes“ Lanthan-Nickel (LaNi5) findet als Wasserstoffspeicher in Nickel-Metallhydrid-Akkumulatoren Verwendung. Als Zusatz kommt es in Kohlelichtbogenlampen zur Studiobeleuchtung und in Filmvorführanlagen (historische Anwendung?) vor.
Einem Legierungsmetall mit Materialzusammensetzungen aus Lanthan und Titan wird die Wirkung zugeschrieben, dass bei spanbildender Verarbeitung die Spanlänge reduziert wird. Dadurch soll die Bearbeitung des Metalls erleichtert werden. Im Bereich der Medizin werden aus dem Legierungsmetall korrosionsbeständige und gut sterilisierbare Instrumente hergestellt. Diese Metalllegierung mit Titan soll für Werkzeuge und Apparate für chirurgische Eingriffe besonders gut geeignet sein, da die Allergie-Neigung bei Verwendung derartiger Metalllegierung mit Titan im Verhältnis zu anderen Legierungen gering sein soll.
Als Lanthancarbonat:
Biologische BedeutungLanthan hat vielleicht eine biologische Funktion. So soll Lanthan angeblich zu Wachstumssteigerung von Pflanzen führen. SicherheitshinweiseLanthan ist schwach giftig und sollte mit Vorsicht gehandhabt werden. VerbindungenIn Verbindungen liegt Lanthan als farbloses La3+ vor.
Quellen
Kategorien: Feuergefährlicher Stoff | Gruppe-3-Element | Periode-6-Element | Chemisches Element |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Lanthan aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||