Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Barium
Barium (von griech. βαρύς: „schwer“, wegen der großen Dichte des Bariumminerals Baryt) ist ein chemisches Element mit dem Symbol Ba und der Ordnungszahl 56. Es ist ein Erdalkalimetall aus der sechsten Periode, das erstmals 1774 von Carl Wilhelm Scheele identifiziert wurde. Barium ist im elementaren Zustand metallisch-glänzend und von silbrig-weißer Farbe. Es kommt in der Natur wegen seiner hohen Reaktivität nicht elementar vor. Barium und seine wasserlöslichen Verbindungen sind giftig. Produkt-Highlight
GeschichteErstmals wurden bariumhaltige Minerale um das Jahr 1600 durch den italienischen Schuhmacher und Alchemisten Vincenzo Casciarolo untersucht, dem glänzende Steinchen auffielen, die nach dem Erhitzen im Dunkeln leuchteten. Sie wurden durch die Publikationen des Ulisse Aldrovandi einem größerem Publikum als „Bologneser Stein“ bekannt. 1774 wurde von dem schwedischen Chemiker Carl Wilhelm Scheele bei der Untersuchung dieses heute als Baryt (Bariumsulfat BaSO4) bekannten Minerals erstmals Bariumoxid BaO identifiziert, das zunächst neue alkalische Erde genannt wurde. Zwei Jahre später fand Johan Gottlieb Gahn die gleiche Verbindung bei ähnlichen Untersuchungen. Ebenfalls im 18. Jahrhundert war dem englischen Mineralogen William Withering in Bleibergwerken Cumberlands ein schweres Mineral aufgefallen, bei dem es sich nicht um ein Bleierz handeln konnte und dem er die Bezeichnung „terra ponderosa“ gab. Es ist heute als Witherit (Bariumcarbonat BaCO3) bekannt. Metallisches Barium, jedoch nicht in Reinform, wurde erstmals 1808 von Sir Humphry Davy in England durch Elektrolyse eines Gemisches aus Bariumoxid und Quecksilberoxid hergestellt. Daraufhin erfolgte die Namensgebung Barium nach dem Bariummineral Baryt. Die erste Reindarstellung des Bariums erfolgte 1855 durch Robert Bunsen und A. Mathiessen durch Schmelzelektrolyse eines Gemisches aus Bariumchlorid und Ammoniumchlorid. 1910 wurde von Marie Curie das schwerere Radium unter Ausnutzung seiner chemischen Ähnlichkeit mit Barium isoliert. Eine wichtige Rolle spielte das Metall auch 1938 bei den kernchemischen Experimenten Otto Hahns und Fritz Straßmanns, die Uran mit langsamen Neutronen beschossen und zu ihrem Erstaunen das viel leichtere Element Barium in den Reaktionsprodukten fanden. Dieser Befund wurde von ihnen korrekt als Spaltung des Urankernes gedeutet, siehe auch Kernspaltung und - sehr ausführlich - „Die Entdeckung der Kernspaltung“. VorkommenBarium kommt wegen seiner hohen Reaktivität in der Natur nicht elementar, sondern nur in Verbindungen vor. Mit einem Anteil von etwa 0,03 % ist Barium das 14. häufigste Element der Erdkruste. Sein Anteil in Böden schwankt zwischen 0,002 % und 0,23 %, liegt im Mittel aber bei 0,05 %. Der Barium-Anteil in der Hydrosphäre schwankt zwischen 10 ppb (Milliardstel Anteilen) im Atlantik und 20 ppb im Pazifik. Barium wird vor allem in den Mineralen Baryt (oder Schwerspat, kristallisiertes Bariumsulfat) und Witherit (Bariumcarbonat) gefunden, und meist aus Baryt gewonnen. Die Weltjahresproduktion an Baryt ist innerhalb der letzten 30 Jahre von etwa 4,8 Millionen Tonnen (1973) auf 6,7 Millionen Tonnen (2003) gestiegen, die weltweiten Reserven werden auf etwa 400 Millionen Tonnen geschätzt. Die deutschen Vorkommen von Bariumverbindungen liegen im Sauerland, im Harz und in Rheinland-Pfalz, das größte Vorkommen der Welt befindet sich in Meggen (Westfalen). Abbauwürdige Vorkommen von Bariumverbindungen gibt es jedoch weltweit: die Hauptförderländer von Barium sind die Volksrepublik China, Mexiko, Indien, Türkei, USA, Deutschland, Tschechien, Marokko, Irland, Italien und Frankreich. Gewinnung und DarstellungJährlich werden etwa 4 bis 6 Millionen Tonnen Barium meist aus Bariumsulfat gewonnen. Die Gewinnung aus Bariumcarbonat ist zwar einfacher, allerdings ist Bariumcarbonat in der Natur seltener zu finden als Bariumsulfat. Technisch wird Barium aus Baryt über Bariumsulfid und Bariumcarbonat in Bariumoxid umgewandelt, das dann mit Silicium, Aluminium oder ähnlichen Stoffen zum Reinmetall reduziert wird. Die Reaktionsgleichungen dieser Prozessfolge lauten:
Hochreines Barium wird durch Elektrolyse von geschmolzenem Bariumchlorid hergestellt. EigenschaftenChemische und physikalische EigenschaftenBarium ist ein festes, paramagnetisches Erdalkalimetall, das in einem kubisch-raumzentrierten Gitter kristallisiert. In den chemischen Eigenschaften ähnelt es Calcium und den anderen Erdalkalimetallen. Es reagiert heftiger als die meisten anderen Erdalkalimetalle mit Wasser und mit Sauerstoff und löst sich leicht in fast allen Säuren - eine Ausnahme bildet konzentrierte Schwefelsäure, da die Bildung einer Sulfatschicht (Passivierung) die Reaktion stoppt. Barium kann deshalb als eines der unedelsten Metalle bezeichnet werden. Wegen dieser hohen Reaktivität wird es unter Schutzflüssigkeiten aufbewahrt (siehe Vorsichtsmaßnahmen). Die silberweiße Farbe des metallischen Bariums wird an der Luft schnell mattgrau, weil sich eine Oxidschicht bildet (siehe Bild).
Barium weist eine grüne bis fahlgrüne Flammenfärbung auf mit den charakteristischen Spektrallinien von 524,2 und 513,7 nm. Barium hat eine Dichte von 3,62 g/cm³ (bei 20 °C) und zählt damit zu den Leichtmetallen. Mit einer Mohshärte von 1,25 ist es vergleichsweise weich, allerdings härter als die anderen Erdalkalimetalle und Blei. Der Schmelzpunkt liegt bei 1.000 K (727 °C), der Siedepunkt bei 1.913 K (1.640 °C). Das elektrochemische Standardpotenzial beträgt -2,912 V. Im Gegensatz zu anderen Erdalkalimetallen bildet Barium nur eine dünne Oxidschicht und kann sich in feuchter Luft selbst entzünden. Eigenschaften des isolierten BariumatomsBarium hat eine Atommasse von 137,327. Der Atomradius beträgt 215 pm (berechnet: 253 pm), der Kovalenzradius 198 pm. Die Elektronenkonfiguration ist [Xe]6s2. Barium kommt in ionischen Verbindungen zweifach geladen vor. Dies lässt sich damit erklären, dass die Summe der ersten und zweiten Ionisationsenergie vergleichsweise niedrig ist, weil sich diese zwei Elektronen in der äußersten Schale befinden, so dass der energetische Aufwand zur Abspaltung zweier Elektronen durch die bei der Bildung des kristallinen Festkörpers freiwerdende Gitterenthalpie kompensiert werden kann. Isotope und radioaktive EigenschaftenIn der Natur kommen sieben stabile Bariumisotope vor, wobei 138Ba mit 71,8 % das häufigste Isotop ist. Des Weiteren sind von Barium 33 radioaktive Isotope mit Halbwertszeiten zwischen 10,5 Jahren bei 133Ba und 150 Nanosekunden bei 153Ba bekannt, wobei die meisten jedoch innerhalb von wenigen Sekunden zerfallen. Barium hat durchgängig Isotope von 58 bis maximal 97 Neutronen (von 114Ba bis 153Ba). Stabile Bariumisotope entstehen bei verschiedenen Zerfallsreihen, beispielsweise des 137I in 137Ba. Die radioaktiven Isotope zerfallen in Lanthan-, Xenon-, Cäsium- und Iodisotope. Folgend zwei Beispiele für Kernspaltungen, bei denen radioaktive Isotope vom Barium entstehen:
VerwendungElementares Barium findet nur wenige Anwendungen, zum Beispiel in Spezialbereichen der Metallurgie. Es wird gelegentlich als Zusatz für Metalllegierungen benutzt und ist Bestandteil vieler Hochtemperatursupraleiter, von Aluminium- und Magnesiumlegierungen als Gettermetall in Elektronenröhren, von Vakuumröhren und von Nickel-Barium-Zündkerzen. Ungeachtet ihrer Giftigkeit finden Bariumverbindungen vielfache Anwendung:
Bariumsulfat (Baryt) spielt eine besondere Rolle, da es wegen seiner extrem geringen Löslichkeit von nur 10-5 Mol pro Liter völlig ungefährlich ist:
NachweisNasschemische MethodenEine Nachweisreaktion ist das Umsetzen mit verdünnter Schwefelsäure, woraufhin weißes Bariumsulfat ausfällt:
Instrumentelle MethodenEin zum Nachweis von Barium geeignetes Verfahren ist die Atomspektroskopie. Der Nachweis von Barium und Bariumsalzen erfolgt hierbei über das charakteristische Spektrum. Gebräuchliche Gerätetypen hierzu sind beispielsweise das Flammenatomabsorptionsspektrometer oder das Atomemissionsspektrometer mit induktiv gekoppeltem Hochfrequenzplasma. Damit können selbst geringe Spuren von Barium nachgewiesen werden. Wenn kein Spektrometer vorhanden ist, kann man unter Umständen auch einfach eine Probe in eine Bunsenbrennerflamme halten, und die grüne Flammenfärbung beobachten. Die Anwendung der Flammenfärbung ist nicht möglich, wenn Elemente mit ähnlichen Flammenfarben anwesend sind. ToxikologieAlle wasser- oder säurelöslichen Bariumverbindungen sind giftig. Die maximale Arbeitsplatzkonzentration (MAK-Wert) liegt bei 0,5 mg/m3. Eine Dosis von 1 bis 15 Gramm ist abhängig von der Löslichkeit der jeweiligen Bariumverbindung für einen Erwachsenen tödlich. Das in der Röntgenologie verwendete wasserunlösliche Kontrastmittel Bariumsulfat, das zur Darstellung des Magen-Darm-Trakts beziehungsweise des Schluckakts in der Videokinematographie eingesetzt wird, muss deshalb frei von löslichen Bariumverbindungen sein, das heißt als Reinsubstanz zugeführt werden. Zu beachten ist hier auch die Verwechselungsmöglichkeit bei den im Sprachgebrauch der Apotheken verwendeten lateinischen Begriffen "Barium sulfuricum" und "Barium sulfuratum". Bariumvergiftungen erfolgen meist am Arbeitsplatz oder in der Nähe Barium-verarbeitender Industriezweige. Dabei kann Barium eingeatmet werden oder über das Trinkwasser in den Organismus gelangen. Abgelagert wird Barium in der Muskulatur, den Lungen und den Knochen, in die es ähnlich wie Calcium, jedoch schneller aufgenommen wird. Seine Halbwertszeit im Knochen wird auf 50 Tage geschätzt. Nachdem Calcium auch an der Zellmembran der Muskulatur durch Barium ersetzt werden kann, wird - in niedriger Dosierung - deren Durchlässigkeit erhöht und die Muskelkontraktion gesteigert, was zu einer Blutdrucksteigerung und Senkung der Herzfrequenz, aber auch zu Muskelkrämpfen führen kann. Höhere Dosen führen zu Muskelschwäche bis hin zu -lähmung, die auf die Beeinträchtigung des Zentralen Nervensystems zurückgeführt wird. Herzrhythmusstörungen (Extrasystolie und Kammerflimmern), Tremor, allgemeines Schwächegefühl, Schwindel, Angst und Atemprobleme können auftreten. Bei akuten wie subakuten Vergiftungen können Störungen des Magen-Darm-Trakts wie Leibschmerzen, Erbrechen und Durchfall auftreten. Viele Symptome werden auch durch den begleitenden Kaliumabfall erklärt. Erste Hilfe kann durch Zugabe von Natriumsulfat- oder Kaliumsulfatlösung erfolgen, wodurch die Bariumionen als schwerlösliches und damit ungiftiges Bariumsulfat gebunden werden. Barium in der belebten NaturPflanzen nehmen Barium aus dem Boden auf und reichern es an. Die höchste Konzentration in einer Nutzpflanze findet sich mit einem Anteil von 1 % entsprechend 10.000 ppm (Millionstel Anteilen) bei der Paranuss. Auf Barium richtiggehend angewiesen sind dagegen die Zieralgen (Desmidiaceae), eine Familie von einzelligen, etwa einen Millimeter großen Grünalgen (Chlorophyta), die in kalten, nährstoffarmen Süßgewässern, insbesondere in Hochmooren vorkommen. In ihren Zellen befinden sich flüssigkeitsgefüllte Hohlräume, in denen sich winzige Bariumsulfatkristalle befinden. Das dazu notwendige Barium wird offenbar selektiv dem Wasser entzogen, selbst bei verschwindend geringen Konzentrationen von nur 1 ppb (Milliardstel Anteil). Auch um Größenordnungen darüber liegende Konzentrationen des leichteren Erdalkalimetalls Calcium ändern daran nichts. Umgekehrt werden für andere Organismen tödliche Bariumkonzentrationen von bis zu 35 ppm (Millionstel Anteile) toleriert. Die biologische Funktion der Kristalle ist noch unklar, eine Rolle bei der Schwerewahrnehmung wird jedoch vermutet. Dass Barium für die Pflanzen essentiell ist, zeigt sich dadurch, dass sie bei Entzug nicht mehr weiter wachsen. Auch im menschlichen Körper kommt Barium vor, der durchschnittliche Gewebeanteil liegt bei 100 ppb (Milliardstel Anteilen), in Blut und Knochen mit jeweils bis zu 70 ppb etwas niedriger. Mit der Nahrung wird täglich etwa ein Milligramm Barium aufgenommen. Verbindungen und ReaktionenEinige der wichtigsten Reaktionen des Bariums sind:
Obwohl Barium selbst ein Leichtmetall ist, weisen einige Bariumverbindungen eine hohe Dichte auf, wie beispielsweise bei Bariumsulfat bereits aus dem Mineraliennamen „Schwerspat“ abzulesen ist. Bariumverbindungen verbrennen mit grüner Flamme. In Verbindungen kommt Barium immer als Ba2+ vor. Wichtige Bariumverbindungen:
Quellenangaben
Literatur
Kategorien: Feuergefährlicher Stoff | Reizender Stoff | Erdalkalimetall | Periode-6-Element | Chemisches Element |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Barium aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||








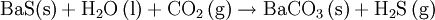
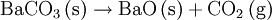
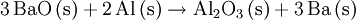
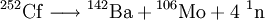
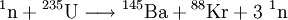
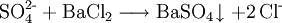 Befindet sich Barium in Gesellschaft mit anderen Elementen, die ebenfalls schwerlösliche Sulfate bilden, so kann dieses Verfahren nicht angewendet werden. Trennung und Nachweis erfolgen dann, sofern nur Erdalkalielemente vorhanden sind nach dem Chromat-Sulfat-Verfahren (siehe unter
Befindet sich Barium in Gesellschaft mit anderen Elementen, die ebenfalls schwerlösliche Sulfate bilden, so kann dieses Verfahren nicht angewendet werden. Trennung und Nachweis erfolgen dann, sofern nur Erdalkalielemente vorhanden sind nach dem Chromat-Sulfat-Verfahren (siehe unter 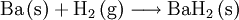
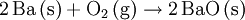
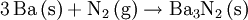
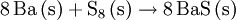
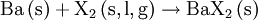
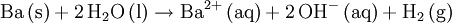
![\mathrm{ Ba\,(s) + 6\,NH_3\,(l) \rightarrow [Ba(NH_3)_6]}](images/math/c/2/d/c2dadf462d2c14648e68ac80b97e1019.png)
![\mathrm{ [Ba (NH_3)_6] \rightarrow Ba(NH_2)_2 + 4\,NH_3\,(g) + 3\,H_2\,(g)}](images/math/8/5/3/853f63ba5845d5e9d406060003ac69b6.png)


