Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Liste der Dichte gasförmiger Stoffe
In der Tabelle sind Gase nach ihrer Dichte aufgelistet. Dichte trockener Gase, wenn nicht anders angegeben, gemessen bei 1,01325 bar Druck und 0°C Temperatur. Auch für hier nicht aufgeführte Gase finden sich oft Angaben zur Dichte in den jeweiligen Stammartikeln. Für Flüssigkeiten und Feststoffe, siehe Liste der Dichte flüssiger Stoffe und Liste der Dichte fester Stoffe. Produkt-HighlightDie Angaben der Tabelle beziehen sich auf Normalbedingungen, also einen Druck von 1013,25 hPa (1,01325 bar) und eine Temperatur von 273,15 K (= 0 °C). Das Volumen dieser Gase beträgt unter diesen Bedingungen, nach dem Gesetz von Avogadro, näherungsweise 22,4 l/mol. Liegen keine Normbedingungen vor, sondern allgemein gemäßigte Drücke (bis etwa 10 bar) und nicht zu niedrige Temperaturen (ab etwa 300 K), so lässt sich die Dichte eines Gases überschlagsweise aus dem idealen Gasgesetz bestimmen: Mit
Für Edelgase gilt die obige Gleichung exakt, für alle anderen ist sie nur als Näherung anzusehen. Sie wird umso ungenauer, je näher die Bedingungen des Gases in die Nähe des Siede- oder kritischen Punktes kommen. Für diese Fälle bieten sich die Virialgleichungen oder die kubischen Zustandsgleichungen an. Kategorien: Liste (Chemie) | Gas |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Liste_der_Dichte_gasförmiger_Stoffe aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





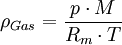
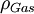 = der Gasdichte in kg/m³
= der Gasdichte in kg/m³
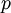 = dem im Gas herrschenden Druck in
= dem im Gas herrschenden Druck in 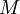 = der
= der 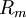 = der allg. Gaskonstante = 8,314 in J/mol/K
= der allg. Gaskonstante = 8,314 in J/mol/K
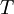 = der absoluten Temperatur in K
= der absoluten Temperatur in K


