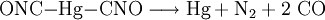Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Knallquecksilber
Knallquecksilber (chemisch: Quecksilber(II)-fulminat) ist das Quecksilbersalz der Knallsäure. Es bildet in reinster Form farblose Kristalle. Knallquecksilber ist giftig und zerfällt schon bei geringer mechanischer oder thermischer Belastung. Produkt-Highlight
GeschichteDas Knallquecksilber wurde wahrscheinlich bereits Ende des 17. Jahrhunderts von Kunkel von Löwenstern und anderen Alchimisten erstmals isoliert. Die Herstellung aus Quecksilber, Ethanol und Salpetersäure wird erstmals 1799 von dem Engländer E.Howard beschrieben. Knallquecksilber wurde früher in Zünd- und Sprengkapseln verwendet, ist allerdings inzwischen durch andere Stoffe ersetzt worden (z. B. Bleiazid). Alfred Nobel setzte Knallquecksilber in Sprengkapseln zur Zündung von Dynamit ein. Erst diese relativ sichere Zündmethode begründete den breiten Erfolgskurs von Dynamit-Sprengstoffen. Allein im deutschen Reich betrug die Jahresproduktion an Knallquecksilber Anfang des 20. Jahrhunderts etwa 100.000 kg[2]. Aufgrund seiner ausgeprägten Initiierfähigkeit war es bis zur Einführung des Bleiazids der am weitesten verbreitete Initialsprengstoff.
Gewinnung und DarstellungQuecksilberfulminat wird durch Umsetzung von elementarem Quecksilber oder Quecksilberoxid mit konzentrierter Salpetersäure in Gegenwart von Ethanol hergestellt. Die Synthese größerer Mengen an Quecksilberfulminat erfordert strenge Sicherheitsvorkehrungen und darf nur durch ausgebildetes Fachpersonal erfolgen. Zur Darstellung kleiner Mengen kann das 1901 von dem Italiener Angelico beschriebene Verfahren für Silberfulminat benutzt werden. Anstelle von Ethanol erfolgt die Umsetzung hier mit wässrigen Lösungen von Malonsäure und Natriumnitrit. Verunreinigungen durch Nebenprodukte können durch ein oder mehrmaliges Umkristallisieren aus Ammoniak-Lösung beseitigt werden. EigenschaftenPhysikalische EigenschaftenQuecksilberfulminat ist in heißem Wasser, Ethanol und in Salpetersäure gut, in kaltem Wasser hingegen nur schlecht löslich. Chemische EigenschaftenBereits bei geringer mechanischer oder thermischer Belastung zerfällt Quecksilberfulminat explosionsartig. Dabei entstehen elementares Quecksilber, Stickstoff und Kohlenstoffmonoxid: Hierbei kann der Zerfall durch Verdämmen oder Zünden größerer Mengen leicht in eine Detonation (v = 5000 m/s) übergehen. Da bei der Explosion eine Wolke von atomarem, giftigem Quecksilberdampf entsteht, wird es als Sprengstoff heute nicht mehr verwendet. SicherheitshinweiseQuecksilberfulminat ist ein Initialsprengstoff und daher besonders explosionsgefährlich. Es kann durch Zündquellen oder mechanische Einwirkung wie Reibung oder Stoß zur Explosion kommen, aber auch durch Aussetzung von Strahlung, durch Trocknen oder Kontakt mit anderen chemischen Verbindungen, wie beispielsweise Schwefelsäure. Quecksilberfulminat ist giftig und umweltgefährlich, für Wasserorganismen stellt es ein besonders hohes Gefahrenpotential dar. Bei Umgang sind größte Vorsicht und Sorgfalt walten zu lassen und besondere Vorkehrungen zu treffen. Unter Wasser gelagert ist es nicht explosionsfähig und chemisch stabil. Siehe auch
Einzelquellen
Literatur
Bilder |
|||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Knallquecksilber aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||||||