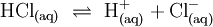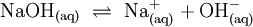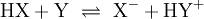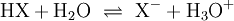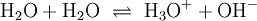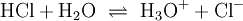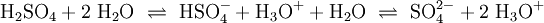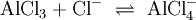Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
S√§ure-Base-KonzepteUm die Begriffe S√§ure und Base haben sich in der Chemie verschiedene Konzepte entwickelt, die auf unterschiedlichen Begriffsdefinitionen beruhen. Der Antrieb dieser Entwicklung beruht einerseits auf der Suche nach einer m√∂glichst umfassenden und allgemeing√ľltigen Definition, anderseits auf einen bestimmten Anwendungsbereich eines Konzeptes. Die Definition nach Br√łnsted und Lowry besch√§ftigt sich mit Protonen√ľbertragungsreaktionen (auch) in Wasser. Sie ist eher eine speziellere Definition, hat aber eine sehr breite Anwendung in der Chemie und ist die √ľblichste Grundlage der S√§ure-Base-Definition. Weiteres empfehlenswertes Fachwissen
Definition nach ArrheniusS. Arrhenius sah 1887 als charakteristische Merkmal einer S√§ure, dass sie in w√§ssriger L√∂sung zu freibeweglichen, positiv geladenen Wasserstoffionen (H+-Ionen) und freibeweglichen negativ geladenen Anionen dissoziiert. Im Gegensatz dazu dissoziierte eine Base nach Arrhenius zu Kationen und OH‚ąí-Ionen. In dieser Definition sind S√§uren und Basen auf Wasser als L√∂sungsmittel beschr√§nkt. Im Gegensatz zu sp√§teren Modellvorstellungen sagte Arrhenius nichts √ľber die Wechselwirkungen der Wasserstoffionen mit Wasser aus. Saure oder basische Reaktionen von Substanzen, die weder H+ noch OH‚ąí-Ionen abgeben k√∂nnen, werden mit diesem Modell nicht erkl√§rt.
Definition nach Br√łnsted und LowryJohannes Nicolaus Br√łnsted und Thomas Lowry beschrieben 1923 unabh√§ngig voneinander eine S√§ure als ein Teilchen, welches Protonen (H+-Ionen) an einen Reaktionspartner, die sogenannte Base √ľbertragen kann. Im Gegensatz zu Arrhenius sind Basen und S√§uren nicht mehr bestimmte Stoffklassen, sondern definierte Teilchen, welche bestimmte Eigenschaften in einer Reaktion mit H+-Ionen zeigen. Eine S√§ure-Base-Reaktion nennt man Protolyse.
Freie Protonen (H+) existieren zu keinem Zeitpunkt. Jede saure Reaktion h√§ngt mit einer Base zusammen, an die die S√§ure ein Proton √ľbertragen kann. Solche Systeme werden als S√§ure-Base-Paare bezeichnet, zwischen denen sich ein chemisches Gleichgewicht einstellt. In dieser Reaktionsgleichung sind HX und HY+ S√§uren, Y und X‚ąí Basen. S√§uren und Basen unterscheiden sich durch ihre F√§higkeit, Protonen aufzunehmen oder Protonen abzugeben. Die praktisch bedeutsamsten Reaktionen sind Reaktionen mit Wasser: Die Lage des Gleichgewichts dieser Reaktion wird durch die S√§urest√§rke bestimmt und wird durch S√§urekonstante der S√§ure HX beschrieben. Kann ein chemischer Stoff sowohl Protonen aufnehmen als auch abgeben, spricht man von einem Ampholyten oder der Eigenschaft amphoter zu sein. Der bekannteste Ampholyt ist Wasser, das sowohl die Bildung von OH‚ąí als auch H3O+ erlaubt. Der S√§urebegriff von Br√łnsted und Lowry erkl√§rt im Gegensatz zu Arrhenius auch die S√§ure-Base-Reaktion von Wasserstoffchlorid-(HCl)- und Ammoniak-(NH3)-Gas zu Ammoniumchlorid (NH4Cl) trotz Abwesenheit von Wasser. Beispiele f√ľr die Reaktion nach Br√łnsted:
Definition nach LewisGilbert Newton Lewis ver√∂ffentlichte 1938/1939 eine Abhandlung √ľber seine S√§ure-Base-Theorie. Demnach ist eine Lewis-S√§ure ein elektrophiler Elektronenpaarakzeptor und eine Lewis-Base ein Elektronenpaardonator. Zu den Lewis-S√§uren z√§hlen:
Alle Basen nach Br√łnstedt und Lowry sind ebenfalls Basen nach Lewis. Beispiel f√ľr eine Lewis S√§ure-Base Reaktion
Definition nach Lux und FloodIm Mittelpunkt des 1939 von Lux aufgestellten und von Flood 1947 erweiterten Konzepts stehen statt Protonen die Oxidionen im Vordergrund. Dieses wurde aufgestellt, um Säure-Base-Reaktionen auch in protonenfreien Systemen beschreiben zu können, wie es in anorganischen Schmelzen vorkommt. Nach Lux und Flood sind Säuren Oxidionen-Akzeptoren, Basen Oxidionen-Donatoren. Man betrachtet dabei Nichtmetalloxide (beispielsweise SO2, CO2) als Säureanhydride, da sie in wässriger Lösung sauer reagieren, entsprechend sind Metalloxide (beispielsweise MgO, Fe2O3) Basenanhydride, da sie in wässriger Lösung Hydroxidionen bilden. Definition nach Usanovich1939 stellte der russische Wissenschaftler Usanovich folgende Definition des Säure-Base-Begriffs auf:
Diese Begriffsdefinition umfasst die Reaktionen nach dem Lewis-Konzept, erweitert selbiges dadurch, dass die Aufnahme beziehungsweise Abgabe von Elektronen nicht auf gemeinsame Paare beschr√§nkt ist, und umfasst alle Redoxreaktionen, bei denen ein vollst√§ndiger Elektronen√ľbergang beteiligt ist. Ein Kritikpunkt dieser wenig gebr√§uchlichen Theorie ist, dass sie zu allgemeing√ľltig ist, und der Begriff S√§ure-Basen-Reaktion auf beinahe jede Art von Reaktion anwendbar ist. Konzept der harten und weichen S√§uren und Basen nach PearsonRalph G. Pearson entwickelte 1963 das Konzept der harten und weichen S√§uren und Basen (Hard and Soft Acids and Bases, HSAB-Konzept). Es lautet:
Betrachtet wird hierbei die Elektronegativität und die Polarisierbarkeit des betrachteten Teilchens:
Das Konzept gibt Tendenzen wieder, es gibt wenige absolut harte oder weiche Teilchen. Es hilft jedoch bei der Absch√§tzung √ľber die Stabilit√§t von Verbindungen. So kommt z. B. das weichere Fe2+ in der Natur als Sulfid vor, w√§hrend das h√§rtere Fe3+ als Hydroxid oder Oxid vorliegt. |
|||||||||||||
| Dieser Artikel basiert auf dem Artikel S√§ure-Base-Konzepte aus der freien Enzyklop√§die Wikipedia und steht unter der GNU-Lizenz f√ľr freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verf√ľgbar. |