Forschung liefert neues Konstruktionsprinzip für wasserspaltende Katalysatoren
Anzeigen
Wissenschaftler wissen seit langem, dass Platin mit Abstand der beste Katalysator für die Spaltung von Wassermolekülen zur Erzeugung von Wasserstoffgas ist. Eine neue Studie von Forschern der Brown University zeigt, warum Platin so gut funktioniert - und das ist nicht der Grund, warum angenommen wird.
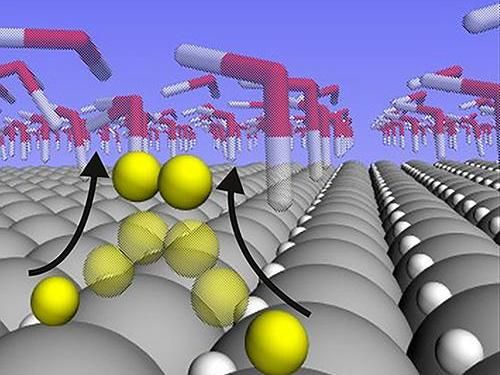
Eine neue Studie zeigt, dass Wasserstoffatome während der Wasserspaltungsreaktion auf der Oberfläche eines Platinkatalysators lose gebunden und hochmobil sind. Die Ergebnisse erklären, warum Platin so gut darin ist, diese spezielle Reaktion zu katalysieren, und könnten beim Design von Katalysatoren aus Materialien helfen, die billiger und reichlicher sind als Platin.
Peterson Lab / Brown University
Die in ACS Catalysis veröffentlichte Forschung trägt dazu bei, eine fast hundertjährige Forschungsfrage zu lösen, sagen die Autoren. Und es könnte helfen, neue Katalysatoren für die Wasserstofferzeugung zu entwickeln, die billiger und reichhaltiger sind als Platin. Das könnte letztendlich dazu beitragen, die Emissionen aus fossilen Brennstoffen zu reduzieren.
"Wenn wir herausfinden können, wie wir Wasserstoff billig und effizient herstellen können, öffnet dies die Tür zu vielen pragmatischen Lösungen für fossile Brennstoffe und Chemikalien", sagte Andrew Peterson, Associate Professor an der Brown's School of Engineering und Senior Author der Studie. "Wasserstoff kann in Brennstoffzellen verwendet werden, kombiniert mit überschüssigem CO2 zur Kraftstoffherstellung oder kombiniert mit Stickstoff zur Herstellung von Ammoniakdünger. Es gibt viel, was wir mit Wasserstoff tun können, aber um die Wasserspaltung zu einer skalierbaren Wasserstoffquelle zu machen, brauchen wir einen billigeren Katalysator."
Die Entwicklung neuer Katalysatoren beginnt mit dem Verständnis, was Platin für diese Reaktion so besonders macht, sagt Peterson, und das ist es, was diese neue Forschung herausfinden wollte.
Der Erfolg von Platin wird seit langem auf seine "Goldilocks"-Bindungsenergie zurückgeführt. Ideale Katalysatoren halten an der Reaktion von Molekülen fest, weder zu locker noch zu fest, sondern irgendwo in der Mitte. Binden Sie die Moleküle zu locker und es ist schwierig, eine Reaktion zu starten. Binden Sie sie zu fest und Moleküle haften an der Oberfläche des Katalysators, was eine Reaktion schwer durchführbar macht. Die Bindungsenergie von Wasserstoff auf Platin ist gerade dabei, die beiden Teile der wasserspaltenden Reaktion perfekt auszugleichen - und so glauben die meisten Wissenschaftler, dass es dieses Attribut ist, das Platin so gut macht.
Aber es gab Gründe, sich zu fragen, ob dieses Bild richtig war, sagt Peterson. So hat beispielsweise ein Material namens Molybdändisulfid (MoS2) eine platinähnliche Bindungsenergie, ist aber ein weitaus schlechterer Katalysator für die Wasserspaltreaktion. Das deutet darauf hin, dass Bindungsenergie nicht die ganze Geschichte sein kann, sagt Peterson.
Um herauszufinden, was geschah, untersuchten er und seine Kollegen die wasserspaltende Reaktion an Platinkatalysatoren mit einer von ihnen entwickelten speziellen Methode zur Simulation des Verhaltens einzelner Atome und Elektronen in elektrochemischen Reaktionen.
Die Analyse zeigte, dass die Wasserstoffatome, die an die Oberfläche von Platin an der Bindungsenergie der "Goldilocks" gebunden sind, bei hoher Reaktionsgeschwindigkeit überhaupt nicht an der Reaktion teilnehmen. Stattdessen schmiegen sie sich in die oberflächenkristalline Schicht des Platins, wo sie inerte Zuschauer bleiben. Die an der Reaktion beteiligten Wasserstoffatome sind weitaus schwächer gebunden als die vermeintliche Energie der "Goldilocks". Und anstatt sich in das Gitter zu schmiegen, sitzen sie auf den Platinatomen, wo sie sich frei miteinander treffen können, um H2-Gas zu bilden.
Es ist diese Bewegungsfreiheit für Wasserstoffatome auf der Oberfläche, die Platin so reaktiv macht, schlussfolgern die Forscher.
"Was uns das sagt, ist, dass die Suche nach dieser Bindungsenergie der "Goldilocks" nicht das richtige Konstruktionsprinzip für die hochaktive Region ist", sagte Peterson. "Wir schlagen vor, dass die Entwicklung von Katalysatoren, die Wasserstoff in diesen hochmobilen und reaktiven Zustand versetzen, der richtige Weg ist."
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.