Chemiker designen „molekulares Flaggenmeer“
Nanostrukturen bauen sich selbst zusammen und bedecken spezifische Oberflächen: „Möglicherweise lassen sich dadurch neuartige Katalysatoren realisieren“
Anzeigen
Forschende der Universität Bonn haben eine molekulare Struktur entwickelt, die Graphit-Oberflächen mit einem Meer winziger beflaggter „Fahnenstangen“ bedecken kann. Die Eigenschaften dieser Beschichtung lassen sich vielfältig variieren. Möglicherweise lassen sich auf ihrer Basis neue Katalysatoren entwickeln. Auch für die Vermessung der nanomechanischen Eigenschaften von Proteinen könnten sich die Verbindungen eignen.

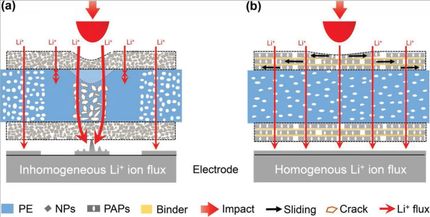
Li.: Rastertunnelmikroskopie-Bild zeigt Moleküle (weiße Ringe) mit ihren drei dunklen Armen. „Fahnenstangen“ = helle Punkte in Ringzentren. Mitte: Modell eines molekularen Mercedesstern-förmigen Moleküls. Re.: Fullerene an Fahnenstangen (weiße Streifen).
© Tristan J. Keller & Joshua Bahr/ Uni Bonn
Grundbaustein der Oberflächen-Abdeckung ist ein großer Molekül-Ring. Er ist innen durch Querverstrebungen stabilisiert und ähnelt daher entfernt einem Mercedesstern. Zudem trägt der Ring drei Ärmchen, die nach außen weisen. Jeder davon kann sich den Arm eines anderen Ringes greifen. Die Moleküle können sich auf diese Weise ohne fremdes Zutun zu einem riesigen flächigen Gewebe zusammenfinden. Dazu reicht es, ein Stück Graphit (das ist das Material, aus dem etwa Bleistiftminen bestehen) in eine Lösung dieser Ringe zu tauchen. Wie von Geisterhand überziehen diese die Graphit-Oberfläche dann binnen kurzer Zeit mit einer netzartigen Struktur.
Die Maschenweite des Netzes lässt sich dabei durch eine Änderung der Ärmchen-Länge genau einstellen. Der eigentliche Clou der Beschichtung liegt aber in einer weiteren Modifikations-Möglichkeit: „Wir können im Zentrum der Ringe winzige Stangen unterschiedlicher Längen anbringen“, erklärt Prof. Dr. Sigurd Höger vom Kekulé-Institut für Organische Chemie und Biochemie der Universität Bonn. Er hat die Studie zusammen mit Dr. Stefan-Sven Jester (ebenfalls Kekulé-Institut) und Prof. Dr. Stefan Grimme vom Mulliken-Zentrum für Theoretische Chemie geleitet. „An ihnen können wir dann wiederum weitere Moleküle befestigen, wie Flaggen an einem Fahnenmast.“
Flaggenmeere im Mini-Format
Die Abstände der Stangen sind dabei so groß, dass sich selbst sehr sperrige Moleküle an ihren Spitzen anbringen lassen, ohne dass sie sich in die Quere kommen. Sie werden dann einerseits durch die Stangen fixiert, sind aber zugleich wie eine Fahne im Wind frei beweglich. Außerdem sind sie für Substanzen, die sich in der Lösung befinden, gut zugänglich und können mit ihnen reagieren. „Möglicherweise lassen sich dadurch neuartige Katalysatoren realisieren“, spekuliert Höger. „Das ermöglicht dann eventuell chemische Reaktionen, die bislang nicht oder nur mit großem Aufwand durchführbar waren.“
An den Spitzen der Fahnenstangen lassen sich im Prinzip beliebige Moleküle befestigen. Dadurch sollte es zukünftig zum Beispiel auch möglich sein, die nanomechanischen Eigenschaften von Proteinen zu vermessen. Das Eiweiß-Molekül würde dazu von der Fahnenstange festgehalten und dann mit einer Art „Greifarm“ auseinandergezogen. „Proteine bestehen aus langen Fäden, die in den meisten Fällen aber zu Knäueln gefaltet sind, wodurch sie ihre charakteristischen Formen annehmen“, sagt Höger. „Die Kräfte, die bei der Bildung eines Knäuels wirken, lassen sich durch solche Experimente genauer bestimmen.“
Im Labor von Dr. Sven Jester wurden die von Höger und seinen Mitarbeitenden hergestellten Moleküle auf Graphit aufgebracht und mit einem Rastertunnelmikroskop untersucht. Zusätzlich wurden die Oberflächen-Muster der Flaggenmoleküle auch am Computer simuliert. „So konnten wir zeigen, dass die Moleküle sich tatsächlich exakt so anordnen und verhalten, wie es unsere Konzepte und die Theorie vorhergesagt hatten“, erklärt Jester, der ebenso wie Höger und Grimme Mitglied im Transdisziplinären Forschungsbereich „Bausteine der Materie und fundamentale Wechselwirkungen“ (TRA Matter) der Universität Bonn ist.
Die Dynamik derart großer und komplexer Moleküle zu simulieren, ist enorm rechenaufwändig. Die Arbeitsgruppe um Prof. Stefan Grimme hat in den letzten Jahren ausgefeilte Methoden entwickelt, mit deren Hilfe das dennoch möglich ist. „Wir können damit beispielsweise in der Simulation zwischen flexibel und starr angebundenen Molekülen unterscheiden und ihr Verhalten vorhersagen“, erklärt Grimme.
So befestigte das Bonner Team unter anderem ein Fußball-ähnliches Molekül an den Fahnenstangen, ein sogenanntes Fulleren. Dort konnte es an einer Art Nano-Schnur frei um die Spitze des jeweiligen Mastes herumbaumeln. „In unseren Rastertunnelmikroskop-Bildern können wir diese durch Computersimulationen vorhergesagte Bewegung der Fullerene tatsächlich sehen“, sagt Jester. Die Bilder der molekularen Fußbälle sind nämlich nicht scharf, sondern verwischt: Sie sind verwackelt – ganz so, als würde man bei schlechtem Licht einen echten Ball an einer Schnur fotografieren, der sich im Wind hin- und herbewegt. Starr befestigte Vergleichsmoleküle sind dagegen in den Rastertunnelmikroskopie-Bildern klar zu sehen.