SCHWARZ PHARMA erhält in den USA die Zulassung für sein Parkinsonpflaster Neupro
Anzeigen
SCHWARZ PHARMA hat mitgeteilt, dass die US-amerikanische Food and Drug Administration (FDA) das transdermale Rotigotinpflaster Neupro® für die symptomatische Behandlung des Frühstadiums der idiopathischen Parkinson-Krankheit zugelassen hat.
"Dies ist für Parkinson-Patienten ein wichtiger Schritt nach vorn. Nach der Zulassung und Markteinführung in Europa ist das Parkinsonpflaster jetzt auch für Patienten in den USA erhältlich", stellt Prof. Dr. Iris Löw-Friedrich, Forschungsvorstand der SCHWARZ PHARMA AG, fest. "Bis Ende 2007 wollen wir bei der FDA auch einen ergänzenden Zulassungsantrag für die Behandlung der Parkinson-Erkrankung im fortgeschrittenen Stadium einreichen."
In Kombination mit Levodopa ist das transdermale Rotigotinsystem in Europa bereits für die Behandlung von Parkinsonpatienten im frühen und fortgeschrittenen Krankheitsstadium zugelassen. Seit März 2006 ist das Arzneimittel in Europa erhältlich. Es wurde von SCHWARZ PHARMA bereits in 14 europäischen Ländern auf den Markt gebracht, u.a. Deutschland, Großbritannien, Österreich, Dänemark, Irland, Norwegen, Schweiz, Schweden, Griechenland, Spanien, Finnland und Polen.
Laut Unternehmen ist Neupro®, das den Wirkstoff Rotigotin enthält, ein non-ergoliner Dopaminrezeptoragonist in der Darreichungsform eines transdermalen Pflasters zur einmal täglichen Verabreichung. Durch Rotigotin soll die Wirkung von Dopamin nachgeahmt werden, einem körpereigenen Neurotransmitter, der für eine einwandfreie motorische Funktion von entscheidender Bedeutung ist. Das Pflaster wird einmal täglich auf die Haut aufgeklebt und ermöglicht dann eine kontinuierliche Rotigotinzufuhr über 24 Stunden.
Meistgelesene News
Themen
Organisationen
Weitere News aus dem Ressort Forschung & Entwicklung

Holen Sie sich die Chemie-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
Songwon kündigt Umstrukturierung zur Stärkung seiner globalen Führungsposition an
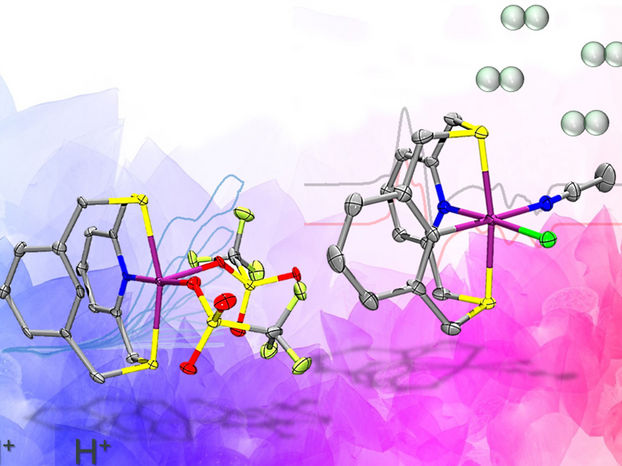
Die Nachahmung biologischer Enzyme könnte der Schlüssel zur Herstellung von Wasserstoffkraftstoff sein - Uraltes Enzym könnte entscheidend für den weltweiten Übergang zu einer Wirtschaft mit erneuerbaren Energien sein

Ressourcen- und kostengünstige Verschleißschutzschichten dank neuem hybriden Beschichtungsverfahren
Neue Grenzwerte: Europa harmonisiert Rückstandshöchstgehalte für Pflanzenschutzmittelzenschutzmittel
ChemBridge Corporation geht mit AstraZeneca neue strategische Allianz im Bereich der chemischen Forschung ein
MediGene erhält US-Patent für Verfahren zur Herstellung von Impfstoff gegen Gebärmutterhalskrebs
Analytikdienstleistungen von Orga Lab für Industrie und Gewerbe jetzt auch ISO 9001 zertifiziert
Otto von Guericke-Preis für neues Verfahren zur Identifizierung von Miroben verliehen
Merck, Applied Materials und die Universität Braunschweig erhalten Fördergelder für die OLED-Forschung
Das Britische Handelsministerium investiert 500 Mio. Pfund in ein neues Institut für Energietechnologien