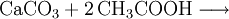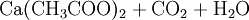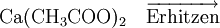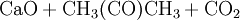Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Aceton
Aceton ist der Trivialname für Propanon oder auch Dimethylketon, das einfachste Keton. Aceton ist eine farblose Flüssigkeit, und findet Verwendung als aprotisches Lösungsmittel und als Edukt für Synthesen der organischen Chemie. Sein charakteristisches Strukturmerkmal ist die Carbonylgruppe, die mit zwei Methylgruppen verbunden ist. Weiteres empfehlenswertes Fachwissen
EigenschaftenAceton ist eine farblose, niedrigviskose Flüssigkeit mit charakteristischem (fruchtartigen/süßlichen) Geruch, in höheren Konzentrationen stechend, leicht entzündlich und bildet mit Luft ein explosives Gemisch. Es ist in jedem Verhältnis mit Wasser und den meisten organischen Lösungsmitteln mischbar. Das Acetonmolekül zeigt Keto-Enol-Tautomerie;.sein pKs-Wert beträgt 20. HerstellungDas wichtigste Herstellungsverfahren von Aceton ist das Cumolhydroperoxid-Verfahren, das auch als Phenolsynthese nach Hock bekannt ist: Hier werden Benzol und Propen zunächst durch eine Friedel-Crafts-Alkylierung im Sauren in Isopropylbenzol (Cumol) überführt, daher der Name der Reaktion. Cumol wird dann mit Sauerstoff oxidiert, wobei ein Hydroperoxid entsteht. Dieses zersetzt sich während der sauren Aufarbeitung zu Phenol und Aceton. Als weiteres Herstellungsverfahren wird die Dehydrierung bzw. Oxidehydrierung von Isopropanol durchgeführt. Eine weitere Möglichkeit der Acetondarstellung besteht darin, Calciumacetat zu erhitzen, wobei es in Aceton und Calciumoxid zerfällt. (Bekannt unter der Bezeichnung "Kalksalzdestillation") ReaktionenAls besondere Reaktion sei hier die Iodierung von Aceton als klassisches Beispiel für eine Reaktionskinetik pseudo-nullter Ordnung genannt. Da sich Iod nur an die Enolform addieren lässt, Aceton aber nahezu zu 100% als Keton vorliegt, kann man bei der Reaktion die Konzentration an 2-Propenol als konstant ansehen: H3C H3C | | C=O ⇌ C-O-H | ǁ H3C H2C An die C=C-Doppelbindung kann nun wie bei der Iodzahlbestimmung Iod addiert werden: H3C H3C | | C-O-H + I2 → I-C-O-H ǁ | H2C H2C-I Im letzten Schritt wird das Keton wieder hergestellt, indem die C-I-Bindung zum Iod hin klappt und gleichzeitig die O-H-Bindung zur C=O-Doppelbindung einklappt. Das Iodid reagiert mit dem freigesetzten Proton zu Iodwasserstoff: H3C H3C | | I-C-O-H → C=O + HI | | H2C-I H2C-I Die gesamte Reaktion ist säurekatalysiert. Bei Zugabe von Base läuft hingegen die Iodoformreaktion ab. VerwendungAceton wird als gängiges Lösungs- und Extraktionsmittel für Harze, Fette und Öle, Kolophonium, Celluloseacetat sowie als Nagellackentferner eingesetzt. Es löst ein Vielfaches seines Volumens an Ethin (Acetylen). Aceton wird in vielen Reaktionen (Aldoladditionen und Aldolkondensationen) der organischen Chemie benutzt und ist in der Lehre oft ein Standardmolekül für Beispiele zur Carbonylchemie. Lässt man je zwei Acetonmoleküle unter dem Einfluss basischer Reagenzien aldolartig dimerisieren, so entsteht Diacetonalkohol. Aceton ist zusammen mit Wasserstoffperoxid eine der Grundchemikalien für die Herstellung des Sprengstoffes Acetonperoxid. In einigen Ländern wird Aceton in kleinen Anteilen (1:2000-1:5000) Benzin oder Diesel zugesetzt, um eine vollständigere Verbrennung des Treibstoffs zu erreichen. BiochemieAceton ist ein Ketonkörper, der nicht in nennenswertem Umfang verstoffwechselt werden kann. Er wird deshalb über die Lunge oder im Ausnahmefall über den Harn abgegeben (Acetonurie, ein Symptom des Diabetes mellitus). Andere Ketonkörper sind Acetylaceton und Hydroxymethylbutyrat. Diese können im Stoffwechsel verarbeitet werden. KomplexchemieAceton kann aufgrund seiner polaren Carbonylgruppe mit Kationen auch Komplexverbindungen bilden. QuellenSicherheitsdatenblätter
Kategorien: Feuergefährlicher Stoff | Reizender Stoff | Keton |
||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Aceton aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||||