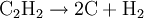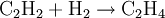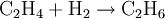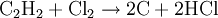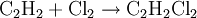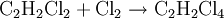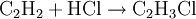Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Ethin
Ethin (Trivialname Acetylen oder Azetylen) ist ein farbloses Gas mit der Summenformel C2H2. Es ist der einfachste Vertreter aus der homologen Reihe der Alkine. Produkt-Highlight
MolekülDas Molekül ist aufgrund der sp-Hybridisierung der Kohlenstoffatome vollkommen linear gebaut; alle Bindungswinkel betragen somit 180°. Die Kohlenstoff-Dreifachbindung hat eine Länge von 120 Picometer, die Kohlenstoff-Wasserstoff-Bindung ist 106 Picometer lang. Die Dreifachbindung im Ethin besteht aus einer sp-Hybridbindung und zwei orthogonalen π-Bindungen. Letztere bilden zwei rotationsinvariante Orbitale. Durch starken s-Charakter der sp-Hybridorbitale ist die Aufenthaltswahrscheinlichkeit der Elektronen der C-H-Bindung in der Nähe des Kohlenstoffs größer als beim Ethen mit sp2-hybridisierten Kohlenstoff bzw. beim Ethan mit sp3-hybridisiertem Kohlenstoff. Daher ist die C-H-Bindung relativ sauer (pKs = 25): Salze des Ethin, sogenannte Acetylide, sind bekannt. GeschichteEthin wurde 1836 von Edmund Davy entdeckt, als er calciniertes Kaliumtartrat mit Holzkohle erhitzte, um Kalium herzustellen; er schrieb seine Beobachtungen jedoch lediglich in sein Laborjournal. 1862 wurde Ethin zum ersten Mal von Friedrich Wöhler aus Calciumcarbid hergestellt. Marcellin Berthelot konnte im selben Jahr Ethin aus den Elementen Kohlenstoff und Wasserstoff herstellen. 1866 beobachtete Berthelot, dass Ethin bei hohen Temperaturen an Metalloberflächen zum Benzol cyclisiert. 1881 wurde Ethanal von Kutscheroff zum ersten Mal aus dem Ethin hergestellt. Die Karbidlampe, welche Ethin als Brenngas verwendet, wurde im Jahr 1902 erstmals in Duluth, Minnesota, patentiert. Um 1930 entwickelte sich in Deutschland die Reppe-Chemie (Ethin-Chemie), da Walter Reppe die Explosionsgefahr des unter Druck gelagerten Ethins minimieren konnte und mit seinen Mitarbeitern viele neue Reaktionen zugänglich machte. Die fensterlosen Labors von Reppe befinden sich in den obersten Gebäudeetagen auf dem Gelände der BASF AG in Ludwigshafen. Die Reppe-Chemie wird in vier Hauptreaktionen zusammengefasst: die Vinylierung, die Cyclisierung, die Ethinylierung und die Carbonylierung des Ethins, die alle bei höheren Drücken ablaufen. Ethin wurde in der organischen Synthese jedoch nach dem Zweiten Weltkrieg vom Ethen weitestgehend verdrängt, weil Ethin teurer herzustellen ist, während Ethen bei industriellen Prozessen in Massen anfällt, seitdem sich die Petrochemie nach dem Zweiten Weltkrieg auf das Erdöl stützt. Dennoch ist es auch heutigen Tages für eine nicht unbedeutende Anzahl von Synthesen wichtig. Giulio Natta polymerisierte Ethin 1958 zum ersten Mal zu Polyethin, dem ersten Halbleiterpolymer, das jedoch an Luft unbeständig ist. Alan Heeger und Alan MacDiarmid aus den USA, sowie der Japaner Hideki Shirakawa zeigten 1976, dass es bei einer Dotierung des Polyethins durch Oxidationsmitteln zu einem sehr starken Anstieg der elektrischen Leitfähigkeit kommt. Die drei Wissenschaftler erhielten im Jahr 2000 den Chemienobelpreis für ihre Arbeit bei der Entwicklung elektrisch leitfähiger Polymere. Eigenschaften und GefahrenIn reinem Zustand ist Ethin geruchlos und ungiftig. Aus Carbid hergestelltes Ethin hat oft einen unangenehmen, leicht knoblauchähnlichen Geruch, der von Verunreinigungen herrührt. Meistens handelt es sich dabei um Phosphan, Ammoniak und Schwefelwasserstoff, die bei der technischen Herstellung aus Calciumcarbid mitentstehen. Die Löslichkeit von Ethin in Wasser beträgt bei Atmosphärendruck nur 1,23 g/kg, wohingegen die Löslichkeit in Alkohol und Aceton (27,9 g/kg unter Standardbedingungen) sehr gut ist. Letzteres wird beim Transport von Ethin in Druckgasflaschen benutzt. Die meisten Druckgasflaschen für Ethin sind heutzutage mit einer porösen Masse aus Calciumsilikathydrat gefüllt, in welche Aceton gegeben wird, das wiederum Ethin in großen Mengen lösen und damit speichern kann. Die poröse Masse verhindert bei einem Flammenrückschlag (Schweißen) durch das Ventil einen möglichen explosionsartigen Zerfall des Ethins in der Flasche. Der Heizwert ist 57.120 kJ/m³ (i. N.). Ethin verbrennt an der Luft mit leuchtender, stark rußender Flamme. Die Flamme wird bei der Verbrennung mit Luft ca. 1.900 bis 2300 °C heiß, bei der Verbrennung mit reinem Sauerstoff sogar bis zu 3.200 °C (Anwendung beim autogenen Schweißen). Ethin ist hochentzündlich. Die Zündtemperatur von Ethin in Luft beträgt bei Atmosphärendruck 305 °C (nach DIN 51794). Zwischen einem Volumenanteil von 2,3 % bis 82 % bildet es in Luft explosive Gemische. Darüber hinaus zerfällt Ethin auch ohne Luft in einer exothermen Reaktion zu Wasserstoff und Ruß unter Freisetzung von beachtlichen 8733 kJ/kg, was 1,9 TNT-Äquivalenten entspricht. Die Zerfallstemperatur von Ethin beträgt bei Atmosphärendruck ca. 640 °C, ist aber sehr stark druckabhängig. Wird Ethin inhaliert, führt es zu Schwindel und Teilnahmslosigkeit. Eine Maximale Arbeitsplatz-Konzentration ist jedoch nicht festgelegt. Ethin darf nicht mit Legierungen mit einem Kupfergehalt von über 70 % in Berührung kommen, da sich ansonsten das hochexplosive Kupferacetylid bilden kann. Vorkommen und HerstellungEthin hat auf der Erde kein natürliches Vorkommen. Außerhalb der Erde wurde es auch in der Atmosphäre des Jupiters sowie in interstellarer Materie nachgewiesen. Die jährliche Weltproduktion lag 1998 bei 122.000 Tonnen. Großtechnisch wird Ethin mittels Hochtemperaturpyrolyse von leichten oder mittleren Erdölfraktionen oder Erdgas bei 2.000 °C hergestellt. Nach der Pyrolyse wird das entstandene Gasgemisch schnell unter 200 °C abgekühlt (gequencht), um die weitere Zersetzung zum elementaren Kohlenstoff und Wasserstoff zu vermeiden. Man erhält dann ein Ethin-Ethen-Gemisch, aus dem das Ethin fraktioniert wird. Die Wärmeübertragung kann verschieden erfolgen; das modernste Verfahren ist die Wasserstoff-Lichtbogen-Pyrolyse, ein älteres, aber noch häufig verwendetes Verfahren ist die Lichtbogen-Pyrolyse. Ein weiteres Verfahren zur Herstellung von Ethin ist die Reaktion von Calciumcarbid mit Wasser: Die direkte Herstellung aus Wasserstoff und Kohlenstoff ist technisch unbedeutend. Sie erfolgt im Lichtbogen bei ungefähr 2.500 °C. Weiter wird Ethen, das bei der Erdölverarbeitung anfällt, zu Ethin dehydriert. Außerdem entsteht es bei der unvollständigen Verbrennung von Methan, dieses Verfahren ist aber nicht wirtschaftlich. Das thermochemische HTP-Verfahren (Hochtemperaturpyrolyse) ermöglicht eine besonders effiziente Gewinnung von Acetylen. VerwendungUngefähr 80 % des Ethins wird für die organische Synthese verwendet. Durch Addition von Halogenwasserstoffen werden Vinylhalogenide und Polyvinylhalogenide, zum Beispiel Vinylchlorid oder Polyvinylchlorid hergestellt. Durch Addition von Essigsäure wird Vinylacetat und Polyvinylacetat hergestellt, durch Addition von Alkohol Vinylether und Polyvinylether. Außerdem werden Cyclooctatetraen, Acrylsäure, Essigsäure, 1,3- sowie 1,4-Butandiol, Propargylalkohol, 2-Butin-1,4-diol, Vinylethin, Bernsteinsäure, Neopren, Chloropren, Vinylester, Polyvinylester, höhere Alkohole, und Monochlorethansäure aus Ethin synthetisiert. Besonders die hergestellten Polymere sind von industrieller Bedeutung. Seltener wird aus Ethin Benzol, Butadien, Ethanol, Acrylnitril und Polyacrylnitril, Vinylhalogenide, Acrylsäure und Acetaldehyd hergestellt. Der aus Ethin gewonnene Acetylenruß wird als Kautschukzusatz bei der Herstellung von schwarzem Gummi oder zur Produktion von Druckerschwärze sowie in Batterien eingesetzt. Aufgrund der hohen Bindungsenergie der Dreifachbindung wurde Ethin auch zu Beleuchtungszwecken (Karbidlampe) verwendet und wird heutzutage häufig als Dissousgas zum autogenen Schweißen und Schneiden verwendet. Im Handel wird es in kastanienbraunen (früher gelben) Flaschen verkauft. Bis in die 1950er Jahre wurde reines Ethin gemischt mit 60 % Sauerstoff, auch Narcylen genannt, als Narkosemittel verwendet. Als es jedoch zu Explosionen kam, wurde es nicht mehr verwendet. In der industriellen Terpen-Synthese, die vor allem als Duft- und Aromastoffe verwendet werden, spielt die Ethinylierung eine Rolle, schon im Grundschritt für alle Terpen-Synthesen wird Ethin mit Aceton in Gegenwart einer Base zum 3-Butin-2-ol ethinyliert, auch in weiteren höheren Schritten findet sich die Ethinylierung immer wieder. Auch bei der Synthese von Vitamin A findet eine Ethinylierung statt: so wird in einem Schritt β-Ionon zu Ethinylionol ethinyliert. ReaktionenEthin ist eine CH-acide Verbindung. Es ist mit einem pKs-Wert von 25 aber deutlich schwächer sauer als Wasser (pKs-Wert 15,7) und saurer als Ammoniak (pKs-Wert 35). Dies bedeutet, dass es in Wasser praktisch nicht dissoziiert. Unter drastischeren Bedingungen (z. B. mit Natriumamid, NaNH2 in flüssigem Ammoniak) wird Ethin leicht deprotoniert und bildet Acetylide:
Die geringe Dissoziation in wässrig-ammoniakalischer Lösung genügt jedoch zur Reaktion des gebildeten Acetylid-Anions mit Übergangsmetall-Kationen, also z. B. Ag+ oder Cu2+, zu sehr schwer löslichen Metallacetyliden, wie z. B. mit Ag+ zu Silberacetylid oder mit Cu2+ zu Kupferacetylid. Das Reaktionsgleichgewicht wird dabei durch die Ausfällung der Acetylide in Produktrichtung verschoben:
Solche Metallacetylide sind in trockenem Zustand extrem schlagempfindlich und explodieren leicht. Bei hohem Druck zerfällt Ethin zu Ruß und Wasserstoff:
Es kann zu Ethen und schließlich zu Ethan hydriert werden:
Mit vielen Katalysatoren lässt sich diese Hydrierung nicht auf der Alkenstufe stoppen. Mit einigen Palladium- oder Nickelkatalysatoren gelingt jedoch bei sorgfältiger Wahl der Reaktionsbedingungen die Ethensynthese aus Ethin Ethin reagiert mit Chlor zu Kohlenstoff und Chlorwasserstoff:
Halogene lassen sich aber auch addieren: so entsteht bei Addition mit Chlor erst Dichlorethen und bei erneuter Addition Tetrachlorethan. Die Addition von Halogen an Ethin erfolgt aber langsamer als beim Ethen, da die C-C-Dreifachbindung weniger nucleophil ist als eine C-C-Doppelbindung:
Analog kann es auch unter Entfärbung der Reaktionslösung mit Brom reagieren. Mit Halogenwasserstoffen können Vinylhalogenide hergestellt werden. So reagiert Ethin mit Chlorwasserstoff zu Vinylchlorid:
Es kann mit Hilfe eines Katalysators zu Vinylalkohol hydratisiert werden, welches zu Acetaldehyd umgewandelt werden kann. Es kann mit Hilfe von Katalysatoren zum Cyclooctatetraen cyclisiert werden; die Cyclisierung von 4 Ethinmolekülen kann aber auch zum Styrol erfolgen: Bei der Carbonylierung wird Ethin mit Kohlenmonoxid und Wasser an Katalysatoren wie zum Beispiel Nickeltetracarbonyl zu ungesättigten Carbonsäuren umgesetzt. So entsteht bei obiger Reaktion Propensäure: Es können auch Alkohole und Carbonsäuren an Ethin addiert werden. Werden Alkohole addiert, so ergeben sich Vinylether, Carbonsäuren ergeben Vinylester:
Literatur
Kategorien: Feuergefährlicher Stoff | Alkin |
|||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Ethin aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||||






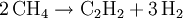
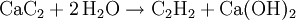
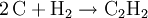
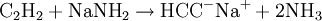
![\mathrm{ C_2H_2 + 2 [Ag(NH_3)_2]^{+} + 2 NO_3^{-} \rightarrow Ag_2C_2 \downarrow + 2 NH_4NO_3 + 2 NH_3 }](images/math/c/0/0/c006a9922d8ecc16e319ea57919749d7.png)