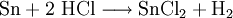Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Zinn(II)-chlorid
Zinn(II)-chlorid (auch Zinnchlorür) ist ein Chlorid des Zinns, das Zinnsalz der Salzsäure. Es bildet farblose oder grauweiße, fettig glänzende Kristalle. Produkt-Highlight
DarstellungDas wasserfreie Zinn(II)-chlorid erhält man durch Erhitzen von Zinn in Chlorwasserstoff: Aus wässriger Lösung fällt das Dihydrat aus. In Sodafabriken füllt man granuliertes Zinn in verschlossene, miteinander verbundene irdene Gefäße und leitet Salzsäuredämpfe aus den Sulfatöfen hinein, worauf man die abgelassene Lösung von Zinn(II)-chlorid zur Kristallisation bringt. Auch aus Weißblechabfällen, welche drei bis fünf Prozent Zinn enthalten, wird Zinn(II)-chlorid mit Salzsäuredämpfen gewonnen. Das Zinn(II)-chlorid kommt als feste Salzmasse oder in Lösung mit überschüssiger Salzsäure in den Handel. Es ist farblos, schmeckt unangenehm metallisch, wird an der Luft feucht, schmilzt bei 40 °C, wird bei 100 °C ganz oder beinahe wasserfrei und gibt bei schnellem Erhitzen auf 100 °C Oxidchlorid, aus welchem bei höherer Temperatur wasserfreies Zinn(II)-chlorid abdestilliert. Es löst sich leicht in Alkohol und in wenig Wasser, gibt mit mehr Wasser ein saures Chlorid und unlösliches, weißes, basisches Zinn(II)-chlorid und nur bei Gegenwart von Salzsäure, Weinsäure oder Salmiak eine klare Lösung. Die Kristalle und die Lösung absorbieren an der Luft Sauerstoff unter Bildung von unlöslichem, weißem Oxichlorid, welches bei Gegenwart von Salzsäure und Zinn wieder reduziert wird. Zinn(II)-chlorid fällt aus Silber- und Quecksilbersalzen die Metalle, reduziert Eisen(III) zu Eisen(II), auch Indigo etc. EigenschaftenEs ist kristallin, schmilzt bei 250 °C und verdampft bei höherer Temperatur unter teilweisiger Zersetzung. Durch Luftsauerstoff erfolgt in wässriger Lösung leicht die Oxidation zu Zinn(IV)-chlorid. Zinnspäne lösen sich in warmer Salzsäure, und die Lösung gibt beim Verdampfen große, durchsichtige Kristalle mit zwei Molekülen Wasser. Dieses Zinnsalz wird im Großen dargestellt, indem man Zinn in Salzsäure löst, wobei das Metall stets im Überschuss vorhanden sein muss, die Lösung bei Gegenwart von etwas granuliertem Zink bis 75 oder 78 °C B. verdampft und zur Kristallisation bringt. Zinn(II)-chlorid fluoresziert blau unter UV-Licht. VerwendungZinn(II)-chlorid wird im Labor als Reduktionsmittel verwendet. In der Galvanik dient es zur elektrolytischen Verzinnung. Zinn(II)-chlorid dient in der chemischen Analyse, in der Färberei zur Reduktion des Indigos und von Eisen- und Manganoxid auf Zeugen, als Beizmittel, namentlich zum Färben mit Cochenille, zum Avivieren und Rosieren, auch zur Darstellung von Goldpurpur und Lackfarben, als Antichlor und zum Entfernen von Rostflecken aus Wäsche. Zinn(II)-chlorid dient als Lösung mit konzentrierter Salzsäure unter dem Namen Bettendorfs Reagenz als Nachweismittel für Arsen und Quecksilber[2]. Dabei kommt es zu einer Braunfärbung der Lösung, da Zinn(II)-chlorid die Arsenverbindung reduziert und so elementares Arsen ausfällt. Die Reaktion wird Bettendorfsche Probe genannt. In der Lebensmitteltechnik wird es als Antioxidationsmittel, Säuerungsmittel und Stabilisator eingesetzt, wobei es Verfärbungen bei weißen Gemüsekonserven (z.B. Spargel) verhindert. In der EU ist es als Lebensmittelzusatzstoff der Nummer E 512 ausschließlich für Spargelkonserven in Gläsern oder Dosen mit einer Höchstmengenbeschränkung von 25 mg/kg für den Zinnanteil im Endprodukt zugelassen. Es gilt in den üblichen Mengen als gesundheitlich unbedenklich, in großen Mengen sind jedoch Magenreizungen möglich.[3] Quellen
Kategorien: Gesundheitsschädlicher Stoff | Chlorid | Zinnverbindung |
|||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Zinn(II)-chlorid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||