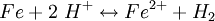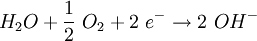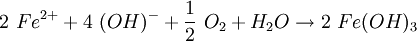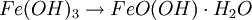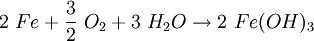Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
RostAls Rost bezeichnet man das Korrosionsprodukt, das aus Eisen oder Stahl durch Oxidation mit Sauerstoff in Gegenwart von Wasser entsteht. Rost setzt sich allgemein aus Eisen(II)-oxid, Eisen(III)-oxid und Kristallwasser zusammen, entsprechend der Summenformel:
Die Oxidationsprodukte, die sich bei hohen Temperaturen auf der Oberfläche von Eisen bilden, heißen Zunder und bestehen aus Eisenoxiden unterschiedlicher Oxidationsstufen. Besonders beim Schmieden von glühendem Eisen platzen durch Hammerschläge von der Oberfläche dünne grauschwarze Eisenoxidschichten ab, die als Hammerschlag bezeichnet werden. Bei anderen Metallen, wie Zink, Chrom, Aluminium oder Nickel, die teilweise auch unedler als Eisen sind, oxidieren nur die obersten Atomlagen zu einer kaum sichtbaren Oxidschicht, die das darunterliegende Metall vor weiterer Reaktion mit Sauerstoff abschirmt (siehe auch Passivierung). Beim Eisen jedoch kommt die Korrosion an der Rost/Materialgrenzfläche nicht zum Stillstand, weil die elektrische Leitfähigkeit des schon gebildeten (feuchten) Rostes und seine Sauerstoffdurchlässigkeit die weitere Korrosion an der Grenze Rost/Material begünstigen. Rost bildet lockere Gefüge geringer Festigkeit. Die Oxidation bewirkt eine Zunahme der Masse und des Volumens. Letztere führt zu Spannungen und zum Abplatzen der Rostschicht (siehe Abbildung rechts). Betonstähle rosten nicht, wenn sie gut gekapselt im Beton eingebettet sind. Zusätzlichen Schutz bietet das alkalische Milieu von Beton. Wenn aber Wasser und Luft Zutritt zum Stahl erhalten, platzt der Beton infolge der Volumenzunahme des Rostes auf und der Zerfall wird beschleunigt. Produkt-Highlight
Elektrochemisches Modell der Rostbildung
Auf einer Eisenoberfläche (grau) liegt ein Wassertropfen (blau), umgeben von Luft (weiß), siehe Schemazeichnung rechts. Gemäß der Spannungsreihe der Elemente diffundieren positiv geladene Eisenatome in die wässrige Umgebung, die Elektronen verbleiben im Metall und laden es negativ auf (Siehe (1) in der Schemazeichnung):
Zunächst könnte man annehmen, das Eisen reagiere mit dem Wasserstoff des Wassers gemäß (Wasserstoffkorrosion):
Die negative Aufladung des Metalls und die Grenzschicht aus positiv geladenen Eisenionen verhindert aber eine schnelle Umsetzung mit Protonen. Ist Sauerstoff vorhanden, kann er den Transport der Elektronen übernehmen. Im Diagramm oben diffundiert Sauerstoff von außen in den Wassertropfen. Der Konzentrationsunterschied im Wassertropfen erzeugt eine Potenzialdifferenz zwischen (2) und (3). Der anodische Bereich (2) und kathodische Bereich (3) bilden mit dem Wasser als Elektrolyten eine galvanische Zelle, die aufgrund des Kurzschlusses zwischen (2) und (3) als Korrosions- oder Lokalelement bezeichnet wird. Bei (3) reagieren die Elektronen mit Wasser und Sauerstoff zu Hydroxid-Ionen:
Die Hydroxid-Ionen bilden mit den Eisenionen Eisen(III)-hydroxid (4). Unter Beteiligung von Sauerstoff und Wasser fällt schwerlösliches Eisen(III)-oxid-hydroxid aus, das sich auf der Eisenoberfläche bei (5) ablagert (Sauerstoffkorrosion): Vereinfacht lautet die Summengleichung aus (A) und (B): Wenn Eisen mit einem anderen Metall in Berührung kommt, entsteht an der Kontaktstelle ebenfalls ein Lokalelement, das zur Korrosion des unedleren Metalls führt. EntrostungStark gerostete Metalle können durch Bürsten von Rost befreit werden. Rostumwandler werden häufig bei der Instandsetzung, z. B. von Autos, eingesetzt. Leichter Rost lässt sich auch mit einer schwachen Säure abwaschen. Geeignet ist beispielsweise verdünnte Phosphorsäure, wie sie in Cola zu finden ist. Damit die Säure das Metall nicht angreift, muss sie mit viel Wasser abgespült werden. Das Metall muss gründlich getrocknet und vor weiterer Korrosion geschützt werden. KorrosionsschutzAus dem Modell lassen sich drei Strategien für den Korrosionsschutz ableiten: Fernhalten von SauerstoffBeispiel: Heizungsrohre aus Eisen rosten innen nicht, wenn das Wasser in einem geschlossenen System ohne Luftzutritt geführt wird. Zudem sinkt die Löslichkeit von Sauerstoff mit steigender Temperatur des Wassers. Man kann diesen Reaktionen aber auch durch verschiedene Schutzmaßnahmen vorbeugen. Ein Beispiel dafür ist die Passivierung – das Überziehen mit solchen unedleren Metallen, die eine stabile Oxidschicht bilden. Überzieht man Metalle mit unedleren Metallen so nennt man dies Galvanisieren, Verzinken oder Verchromen. Um den Zutritt von Wasser zu verhindern, kann man Metalle lackieren oder mit einem Kunststoffüberzug versehen. Fernhalten von Feuchtigkeit, die als Elektrolyt wirkt
Beispiel 1: In Ländern mit geringer Luftfeuchtigkeit gibt es praktisch keine Rostschäden an Autos. Beispiel 2: Schutzschichten aus Fett, Lack oder Metallauflagen schirmen Eisen von der Umgebung ab (Feuerverzinken, Weißblech), siehe Bilder links und rechts. Beispiel 3: Eine Eisenlegierung mit einem Chromanteil von mehr als 12 % (=Rostfreier Stahl) wird durch die Chromoxidschicht vor Oxidation geschützt.
Abbau der Potenzialdifferenz in LokalelementenBeispiel 1: Feuerverzinkung schützt Eisen nachhaltig vor Rostbefall. Kommt es zu einer Schädigung der Beschichtung, bilden Zink und Eisen bei Zutritt von Wasser ein Lokalelement (ähnlich einer Batterie). Zink als das unedlere Metall korrodiert und bewahrt das Eisen vor Oxidation. Bei einer Beschichtung mit einem edleren Metall (zum Beispiel Zinn bei Weißblech) tritt der umgekehrte Fall ein. Das Eisen rostet, möglicherweise verdeckt von der Schutzschicht (siehe Bild der Getränkedose, Rösti). Die Anwesenheit eines edleren Metalls fördert sogar die Oxidation. Das Lokalelement aus Eisen und dem edleren Metall verhindert die schützende negative Aufladung des Eisens (siehe oben). Beispiel 2: Eisenrohre werden elektrisch mit einer sogenannten Opferanode aus einem unedleren Metall verbunden. Wie im ersten Beispiel wird Eisen auf Kosten der Opferanode geschützt, sofern beide über einen Elektrolyten, zum Beispiel feuchtes Erdreich, im Kontakt stehen. Beispiel 3: Statt einer Opferanode schützt auch eine elektrisch leitende Elektrode (zum Beispiel Graphit), wenn sie über eine externe Gleichspannungsquelle auf einem positiven Potenzial relativ zum Eisen gehalten wird. Siehe auchLiteratur
Kategorien: Chemische Reaktion | Korrosion | Eisen |
|
| Dieser Artikel basiert auf dem Artikel Rost aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |


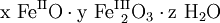 (x, y, z positive Verhältniszahlen).
(x, y, z positive Verhältniszahlen).


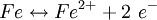
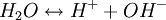 Dissoziation des Wassers in Protonen (
Dissoziation des Wassers in Protonen (