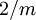Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Borax
Borax, auch als Tinkal, Natriumborat oder unter seiner chemischen Bezeichnung Dinatriumtetraborat-Decahydrat [3] bekannt, ist ein eher selten vorkommendes Borat-Mineral aus der Mineralklasse der Gruppenborate. Es kristallisiert im monoklinen Kristallsystem mit der chemischen Formel Na2[B4O5(OH)4] · 8 H2O [4] oder Na2B4O7 · 10 H2O bzw. Na2O · 2 B2O3 · 10 H2O [5] und entwickelt meist kurze, prismatische oder tafelige Kristalle, aber auch erdige, körnige oder massige Aggregate von meist weißer oder grauer Farbe. Gelegentlich ist es auch farblos. Produkt-Highlight
Besondere EigenschaftenBeim Erhitzen verliert es bei etwa 100 °C einen Teil seines Kristallwassers und bildet ein Pentahydrat. Oberhalb von 400 °C erhält man wasserfreies Natriumtetraborat, das bei 878 °C schmilzt. Die molare Masse von Natriumtetraborat beträgt 201,22 g·mol−1, die des Decahydrats 381,37 g·mol−1. Die Dichte der wasserfreien Substanz ist 2,37 g·cm−3, die des Decahydrats 1,72 g·cm−3 [3]. Etymologie und GeschichteBorax wurde zuerst 1748 durch den schwedischen Mineralogen Johan Gottschalk Wallerius beschrieben. Der Name leitet sich von dem arabischen Wort bauraq für „weiß“ ab.[1] Es wurde schon in der Antike in China für Glasuren und in Ägypten zum Einbalsamieren benutzt. Bildung und FundorteBorax kommt in der Natur in kristalliner oder massiver Form ähnlich wie Anhydrit oder Gips als Evaporit vor, entsteht also durch die Austrocknung von Salzseen, die dann auch Boraxseen genannt werden und tritt daher als Sediment auf. Daneben findet man es auch in vulkanischen Schloten. Ein natürliches Vorkommen gibt es in Boron in Kalifornien, wo es im Tagebau abgebaut wird. Weitere Fundorte sind unter anderem Kırka in der Türkei, sowie Borax Lake und Searles Lake/Kalifornien in den USA.[2] Borax wird heute nahezu ausschließlich aus dem kristallwasserärmeren Boraxmineral Kernit gewonnen. Verwendungals RohstoffBorax ist ein wichtiger Rohstoff zur Herstellung von Borsäure, zur Gewinnung von Boraten und Perboraten sowie weiterer Bor-Verbindungen. Borax wird für Glasuren auf Steingut, Keramik, Porzellan, Glas und bei der Emailproduktion verwendet. Seine Verwendung als Flussmittel beim Hartlöten von Edelmetallen, sowie beim Feuerschweißen und Schmieden beruht auf seiner oxidablösenden Wirkung (Antioxidationsmittel).[6] Borax ist neben Polyvinylalkohol, destilliertem Wasser und Lebensmittelfarbe eine Grundsubstanz zur Herstellung des Spielzeugs Slime (Schleim).[7] in der ChemieIn der Schmelze von Borax lösen sich zahlreiche Metalloxide unter Bildung charakteristischer Färbungen und bilden nach dem Abkühlen eine glasartige Perle, die Boraxperle. Diese Färbungen werden als Nachweis für Kationen beim Kationentrennungsgang eingesetzt. Die bei der Verbrennung von Methanol mit Borax auftretende grüne Flammenfärbung, die durch Borsäuretrimethylester hervorgerufen wird, ist ein einfacher Nachweis für Methanol. Daneben wird Borax für Pufferlösungen (Borat- sowie Borat-Phosphat-Puffer) und in der Borax-Karmin-Lösung (Grenachers-Lösung) als Farbstoff in der Mikroskopie verwendet. im HaushaltIm Haushalt findet Borax Anwendung in Seife, in Wasserenthärtern, und als Perborat in Waschmitteln. Borax wird in Desinfektions-, Putz- und Bleichmitteln sowie in Insektiziden (bei Ameisenfallen) eingesetzt. Des Weiteren wirkt Borax als vorbeugendes Holzschutzmittel gegen Schimmel und Insekten[6] und wird zu etwa ein Prozent der insgesamt verbrauchten Menge als Flammschutzmittel, hier vorwiegend für Dämmstoffe auf Zellulosebasis, eingesetzt. In letztgenannter Anwendung werden seine Eigenschaften als teilweise problematisch angesehen und eine Minderung als sinnvoll erachtet.[8] Als Lebensmittelzusatzstoff hat es die Bezeichnung E 285. Vorsichtsmaßnahmen[[Hilfe:Cache|Fehler beim Thumbnail-Erstellen]]:
Borax kann bei Haut- oder Augenkontakt sowie beim Einatmen des feinen Pulvers Entzündungen hervorrufen. Bei Verschlucken kann es zu Reizungen des Magen-Darm-Trakts kommen; größere Mengen wirken tödlich (R- und S-Sätze: R: 36/37-62}}}">{{{3}}}}}}">{{{4}}}}}}">{{{5}}}}}}">{{{6}}}}}}">{{{7}}}}}}">{{{8}}}}}}">{{{9}}}}}}">{{{10}}}}}}">{{{11}}}}}}">{{{12}}}}}}">{{{13}}}}}}">{{{14}}} }} }} }} }} }} }} }} }} }} }} }} }} }} | }} }}, S: 22-26-36/37/39-45}}}">{{{5}}}}}}">{{{6}}}}}}">{{{7}}}}}}">{{{8}}}}}}">{{{9}}}}}}">{{{10}}} }} }} }} }} }} }} }} }} }} | }} }} }}) [3]. Die CAS-Nummer des wasserfreien Natriumtetraborat ist 1330-43-4, die des Pentahydrats 1332-28-1 und die von Borax (Natriumtetraborat-Decahydrat) 1303-96-4. Siehe auchEinzelnachweise
Literatur
Kategorien: Mineral | Bormineral | Natriummineral | Monoklines Kristallsystem | Carbonate, Nitrate und Borate |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Borax aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||