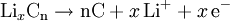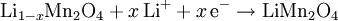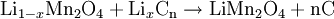Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Lithium-Ionen-AkkumulatorEin Lithium-Ionen-Akkumulator (Lithium-Ionen-Akku, Li-Ionen-Akku oder (sekundäre) Li-Ionen-Batterie) ist eine elektrochemische Spannungsquelle auf der Basis von Lithium. Er ist im Gegensatz zur Lithium-Batterie wiederaufladbar. Eine Weiterentwicklung des Li-Ionen-Akkus ist der Lithium-Polymer-Akku, eine andere Weiterentwicklung der Lithium-Titanat-Akku. Der Li-Ionen-Akku zeichnet sich durch seine hohe Energiedichte aus. Seine nutzbare Lebensdauer beträgt mehrere Jahre; allerdings ist dies stark von der Nutzung und den Lagerungsbedingungen abhängig. Li-Ionen-Akkus versorgen tragbare Geräte mit hohem Energiebedarf, für die herkömmliche Akkus zu schwer oder zu groß wären, beispielsweise Mobiltelefone, Digitalkameras, Camcorder oder Laptops sowie Elektro- und Hybridfahrzeuge. Neuerdings werden Lithium-Ionen-Akkus auch bei Elektrowerkzeugen wie zum Beispiel Akkuschraubern verwendet. Produkt-Highlight
Kennwerte
Ein konventioneller Li-Ionen-Akku liefert eine Nennspannung von 3,7 Volt, die damit rund dreimal so hoch wie die eines NiMH-Akkus ist. Die Energiedichte ist mit ca. 100 Wh/kg etwas geringer als die von Alkali-Mangan-Batterien, aber deutlich größer als die konventioneller Akkus. Achtet man auf eine Entladespannung von minimal 3,5 V, um die Lebensdauer zu erhöhen, reduziert sich die Energiedichte auf ca. 60–70 Wh/kg. Heutige Li-Ionen Akkus für Kraftfahrzeuge erreichen allerdings schon eine Energiedichte von über 120 Wh/kg. Die Kapazität eines Lithium-Ionen-Akkus verringert sich selbst ohne Benutzung mit der Zeit, hauptsächlich durch parasitäre Reaktion des Lithiums mit den Elektrolyten. Die Zersetzungsgeschwindigkeit steigt mit der Zellspannung und der Temperatur. Eine Tiefentladung unterhalb 2,4 V kann den Akku dauerhaft schädigen. Hersteller empfehlen eine Lagerung bei 15 °C und einem Ladestand von 60 %, ein Kompromiss zwischen beschleunigter Alterung und Selbstentladung. Ein Akku sollte etwa alle sechs Monate auf 40 bis 60 % nachgeladen werden. Zur Zeit gilt die Faustregel, dass ein Li-Ionen-Akku nach ca. drei Jahren mehr als 50 % seiner Kapazität eingebüßt hat. Generell sollte das Entladen unter 40 % vermieden werden, da es bei „tiefen Zyklen“ zu größeren Kapazitätsverlusten aufgrund irreversibler Reaktionen in den Elektroden kommen kann. Grundsätzlich ist es besser, Li-Ionen-Akkus „flach“ zu zyklen, wodurch sich deren Lebensdauer verlängert. Da bei Kälte die chemischen Prozesse (auch die Zersetzung des Akkus bei der Alterung) langsamer ablaufen und die Viskosität der in Li-Zellen verwendeten Elektrolyte stark zunimmt, erhöht sich auch beim Lithium-Ionen-Akku bei Kälte der Innenwiderstand, womit die abgebbare Leistung sinkt. Zudem können die verwendeten Elektrolyte bei Temperaturen um –25 °C einfrieren. Manche Hersteller geben den Arbeitsbereich mit 0–40 °C an. Optimal sind 18–25 °C. Unter 10 °C kann durch den erhöhten Innenwiderstand die Leistung so stark nachlassen, dass sie nicht lange für den Betrieb eines Camcorders oder einer Digitalkamera ausreicht. Es gibt aber Li-Ionen-Akkus mit speziellen Elektrolyten, die bis −54 °C eingesetzt werden können. Kraftfahrzeuge mit Hybridantrieb werden bislang mit Nickel-Metallhydrid-Akkumulatoren betrieben, weil Lithium-Ionen-Akkumulatoren zuweilen für Autos nicht sicher genug sind. Bei thermischer Belastung kann es in den Lithium-Ionen-Batterien zu einem Schmelzen des Batterieseparators und damit zu einem Kurzschluss mit verheerenden Folgen kommen. Neuartige keramische und temperaturbeständigere Separatoren gewähren allerdings eine erhöhte Sicherheit. Herkömmliche Li-Ionen-Akkus dürfen nur mit spezieller Elektronik geladen werden. Bei einer Tiefentladung oder Überladung schaltet im günstigsten Fall eine interne Sicherung den Akku, meist nur temporär, ab. Im Falle einer Tiefentladung liegt dann an den externen Kontakten des Akkupacks überhaupt keine Spannung mehr an, d. h., er kann nicht noch weiter entladen werden. Leider weigern sich etliche Geräte einen derartig defekt anmutenden Akku wieder zu laden, da in diesem Fall an den externen Kontakten nur eine Spannung von 0 V messbar ist, obwohl der Akku von seiner Schutz-Elektronik wieder an die Kontakte geschaltet werden würde, sobald ein Ladestrom anliegt. Ein anderes Ladegerät zu probieren kann in solchen Fällen weiterhelfen. Im Falle einer Überladung wird der Akku von den externen Kontakten getrennt, bis keine zu hohe Lade-Spannung mehr anliegt. Danach kann er meist ohne Probleme wieder verwendet werden. Falls allerdings keine Schutz-Elektronik vorhanden oder selbige defekt ist, kann der Akku Feuer fangen oder gar explodieren. Aus diesem Grund wurden in den Anfängen der Lithium-Ionen-Technik im Modellbau die Akkumulatoren oft in Aluminiumkoffern transportiert, um den Benutzer vor möglichen Verletzungen zu schützen. Bei Akku-Packs kleiner und mittlerer Baugröße ist die Elektronik zum Schutz gegen Tiefentladung sowie eine selbstrückstellende Sicherung gegen Überstrom bereits in das Akku-Pack integriert. Die Ladeelektronik allerdings ist entgegen landläufiger Meinung meist nicht im Akku-Pack integriert, sondern im damit betriebenen Gerät. PrinzipEin Lithium-Ionen-Akku erzeugt die elektromotorische Kraft durch die Verschiebung von Lithium-Ionen. Beim Ladevorgang wandern positiv geladene Lithium-Ionen durch einen Elektrolyten hindurch von der positiven Elektrode zur negativen, während der Ladestrom die Elektronen über den äußeren Stromkreis liefert. Eine negative Elektrode aus Lithium-Metall ist elektrochemisch optimal, für einen Akku aber ungeeignet. Da sich die Elektrode beim Entladevorgang genauso wie bei einer Lithium-Batterie auflöst, besteht beim Ladevorgang keine Möglichkeit mehr, ihre Geometrie zu rekonstruieren. AufbauDas aktive Material der negativen Elektrode eines gängigen (2005) Li-Ionen-Akkus besteht aus Graphit. Die positive Elektrode enthält meist Lithium-Metalloxide in Schichtstruktur wie LiCoO2 (Lithiumcobaltoxid), LiNiO2 oder dem Spinell LiMn2O4. Der Lithium-Ionen-Akkumulator muss komplett wasserfrei sein (Gehalt an H2O <20 ppm), da sonst das Wasser mit dem Leitsalz LiPF6 zu HF (Flusssäure) reagiert. Meist wählt man eine Mischung von wasserfreien, aprotischen Lösungsmitteln (Ethylencarbonat, Propylencarbonat) mit niedrigviskosen Alkylcarbonaten/Äthern (Dimethylcarbonat, Diethylcarbonat oder 1,2-Dimethoxyethan) und Lithiumsalzen als Elektrolyten. Beim Laden, d. h. beim Anlegen eines äußeren Potenzials, wandern Lithium-Ionen zwischen die Graphitebenen (nC); sie bilden mit dem Kohlenstoff eine Interkalationsverbindung (LixnC). Beim Entladen wandern die Lithiumionen zurück in das Metalloxid und die Elektronen können über den äußeren Stromkreis zur positiven Elektrode fließen. Wesentlich für das Funktionieren der Interkalation ist die Ausbildung einer schützenden Deckschicht auf der negativen Elektrode, welche für die kleinen Li+-Ionen permeabel, für Lösungsmittelmoleküle jedoch undurchlässig ist. Ist die Deckschicht ungenügend ausgebildet, kommt es zur Interkalation von Li+-Ionen mitsamt den Lösungsmittelmolekülen, wodurch die Graphitelektrode irreversibel zerstört wird. Mit folgenden Materialien wird experimentiert (die älteren Materialien zuerst):
ReaktionsgleichungenNegative Elektrode (Entladung): Positive Elektrode (Entladung): Redox-Gleichung: Metallisches Lithium kommt also in keiner Reaktion vor, es werden lediglich Li+-Ionen zwischen den Elektroden transferiert. Dadurch sind Li-Ionen-Akkus sicherer als Li-Batterien. Zwar wäre metallisches Lithium aufgrund der wesentlich größeren Energiedichte günstiger, jedoch scheidet sich Lithium aufgrund der Deckschichten auf der Elektrodenoberfläche nicht als kompaktes Metall, sondern fein verteilt ab, wodurch sich ein hochreaktiver Li-Schwamm bildet. Durch Dendritenwachstum durch den Separator kann es zum Kurzschluss und dadurch zum Entzünden des Lithiums kommen. Lagerung und SicherheitshinweiseLithium ist ein hochreaktives Metall. Auch wenn es wie bei Lithiumbatterien als Li-Verbindung vorliegt, sind die Komponenten eines Li-Ionen-Akkus leicht brennbar. Ausgleichsreaktionen beim Überladen, zum Beispiel die Zersetzung von Wasser wie bei anderen Akkus, sind nicht möglich. Interne Schutzschaltungen sollten ein Verpuffen verhindern; auf alle Fälle zerstören sie die Funktionsfähigkeit des Akkus. Mechanische Beschädigungen können zu inneren Kurzschlüssen führen. Die hohe Stromstärke lässt das Gehäuse schmelzen und in Flammen aufgehen. Unter Umständen ist der Defekt nicht unmittelbar zu erkennen. Noch 30 Minuten später kann es zum Ausbruch eines Feuers kommen. Lagerung
Sicherheitshinweise
Literatur
|
|
| Dieser Artikel basiert auf dem Artikel Lithium-Ionen-Akkumulator aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |