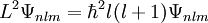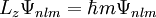Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
WasserstoffatomEin Wasserstoffatom ist ein Atom des chemischen Elements Wasserstoff, das normalerweise nur als zweiatomiges Wasserstoffgas vorkommt (H2). Das Atom besteht aus einem einfach positiv geladenen Atomkern (mit einem Proton und null bis zwei Neutronen) und einem negativ geladenen Elektron. Elektron und Atomkern sind aufgrund ihrer entgegengesetzten elektrischen Ladung aneinander gebunden (coulombsches Gesetz). Das Wasserstoffatom ist das am einfachsten aufgebaute aller Atome und bietet daher den Schlüssel zum Verständnis des Aufbaus und der Eigenschaften aller Atome. Es ist das einzige Atom, für das die quantenmechanische Schrödinger-Gleichung analytisch, d. h. in mathematisch geschlossener Form, gelöst werden kann. Die Spektrallinien des Wasserstoffatoms sind mit hoher Genauigkeit berechenbar, und können mit den gemessenen Werten verglichen werden, wie zum Beispiel das bekannteste Linienmultiplett, die Balmer-Serie. Produkt-Highlight
Geschichte der Modellvorstellung des WasserstoffatomsDas 1913 entwickelte bohrsche Atommodell stimmte in seiner Vorhersage der Spektrallinien gut mit experimentellen Beobachtungen überein, und zeigt auch eine hohe Übereinstimmung mit den 1925/26 berechneten quantenmechanischen Werten. Das quantenmechanische Modell lieferte zusätzlich die geometrische Struktur der Elektronenorbitale, und löste das bohrsche Atommodell mit seinen 'ad hoc' Annahmen ab. Verfeinerungen des quantenmechanischen Modells führten zu theoretischen Bestätigungen in der Detailstruktur der Spektrallinien des Wasserstoffatoms, das damit gleichzeitig zum Standardtest der Quantenmechanik avancierte. Wichtige Phänomene, die anhand des Wasserstoffatoms erkannt oder verstanden wurden, sind unter anderem das Pauli-Prinzip und der Zeeman-Effekt. Die am Wasserstoffatom abgeleiteten Prinzipien der Atomphysik bilden die Grundlage zur Beschreibung aller Atome. Allerdings kann das quantenmechanische Modell bei Atomen mit mehr als einem Elektron nur näherungsweise gelöst werden. Weiter haben Kenntnisse von Aufbau und Eigenschaften des Wasserstoffatoms zum Verständnis des Aufbaus chemischer Moleküle beigetragen. Experimentelle Untersuchungen der LinienspektrenSeit 1885 werden die Absorptions- und Emissionsspektren des Wasserstoffatoms untersucht. Sie werden verursacht durch den Übergang des gebundenen Elektrons von einem höheren in ein niedrigeres Niveau (Emission) oder umgekehrt (Absorption). Dabei werden die möglichen Linien klassifiziert nach dem Grundniveau und benannt nach ihren jeweiligen Entdeckern. Mathematisch werden die Übergänge durch die Rydberg-Formel beschrieben.
Lösung der Schrödinger-GleichungDie dreidimensionale Schrödinger-Gleichung (eine partielle Differentialgleichung) kann aufgrund der Kugelsymmetrie der elektromagnetischen Wechselwirkung in drei unabhängige Gleichungen separiert werden. Jede der drei Einzelgleichungen kann mathematisch exakt gelöst werden. Die wichtigste Gleichung ergibt die Energiezustände und Energiewerte des Elektrons im Wasserstoffatom; es ist üblich, die verschiedenen diskreten Energiewerte als Hauptquantenzahl En zu bezeichnen. Der tiefste Energiezustand ist E1, die weiteren Anregungszustände sind E2 und E3. Die beiden anderen Gleichungen enthalten die Winkelabhängigkeit (Bahndrehimpulsquantenzahl, magnetische Quantenzahl). Das Wasserstoffatom ist eines der wenigen quantenmechanischen Systeme, die sich exakt berechnen lassen. Die Lösung der Schrödinger-Gleichung für das Wasserstoffatom ist auch deshalb ein Standardverfahren der universitären Physik- und Chemieausbildung. Mathematische Details
Die Separation der Schrödinger-Gleichung führt zu drei Gleichungen, die von jeweils einer der drei Kugelkoordinaten r (Abstand vom Mittelpunkt), Jede Lösung Ψ der Schrödinger-Gleichung für das Wasserstoffatom wird durch die drei Zahlen n,l,m, Quantenzahlen genannt, gekennzeichnet. Dabei ist die Haupt- oder Energiequantenzahl n eine beliebige positive Zahl, die Drehimpulsquantenzahl l nimmt für gegebenes n die Werte von 0 bis n − 1 an, und die magnetische Quantenzahl m läuft für gegebenes l von − l bis + l. Die Lösungsfunktion ist dann mit
Für die niedrigsten Orbitale ergibt sich damit: Die Energieeigenwerte sind
Hierin ist α die Feinstrukturkonstante und mr die reduzierte Masse des Systems aus Elektron und Proton. Die Drehimpuls- und magnetischen Eigenwerte sind durch und gegeben. Die Drehimpulsquantenzahl misst hierbei den Bahndrehimpuls des Elektrons, und die magnetische Quantenzahl seine Projektion auf eine beliebige, im allgemeinen als 'z' bezeichnete, Richtung. In dieser einfachsten Behandlung des Wasserstoffatoms sind die Energiewerte nur von der Hauptquantenzahl n abhängig. Alle Lösungen mit gleichem n besitzen die gleiche Energie, man sagt, sie sind entartet bezüglich der Quantenzahlen l und m. Unter Berücksichtigung weiterer Effekte (Spin, Relativitätstheorie) ergibt sich eine Aufhebung der Energieentartung. Weitere EntwicklungDie Schrödinger-Gleichung gibt eine in erster Näherung ausgezeichnete Beschreibung des Wasserstoffatoms. Sie vernachlässigt allerdings eine Reihe von zweitrangigen Eigenschaften der beteiligten Elementarteilchnen, die experimentell nachweisbar sind. Durch Berücksichtigung dieser Eigenschaften im erweiterten quantenmechanischen Modell lassen sich jene Beobachtungen ebenfalls erklären. Relativistische EffekteDie Schrödingergleichung ist eine nichtrelativistische Gleichung und verwendet den klassischen Ausdruck für die kinetische Energie, zur korrekten Beschreibung muss man deshalb eigentlich die Dirac-Gleichung verwenden. Beim Wasserstoffatom ist der Energieunterschied aber nicht sehr groß, daher kann man die Effekte störungstheoretisch im Rahmen der Schrödinger-Gleichung behandeln, um genauere Werte für die Energieeigenwerte zu erhalten. SpinDer Spin des Elektrons ist ebenfalls ein nicht klassischer Effekt, der sich exakt in der Dirac-Gleichung verstehen lässt. Aufgrund seines Spins besitzt das Elektron ein magnetisches Moment, das mit anderen magnetischen Momenten und Magnetfeldern wechselwirken kann. Die Wechselwirkung mit dem magnetischen Moment, welches das Elektron durch seine Bewegung um den Atomkern erzeugt, wird dabei als Spin-Bahn-Kopplung bezeichnet. Die Spin-Bahn-Kopplung und andere relativistische Effekt bewirken eine Aufspaltung der nicht-relativistisch entarteten Energieniveaus, die Feinstruktur des Wasserstoffatoms. Berücksichtigt man noch die Wechselwirkung von Spin und Bahndrehimpuls mit dem Kernspin, ergibt sich eine noch feinere Aufspaltung, die sogenannte Hyperfeinstruktur. In Anwesenheit von Magnetfeldern beobachtet man aufgrund des Spins des Elektrons den anomalen Zeeman-Effekt. Quantenfeldtheoretische EffekteDie Quantenmechanik ist eine Annäherung an die zugrundeliegende Quantenfeldtheorie, in der unter anderem Vakuumfluktuationen auftreten. Diese bedingen die Lamb-Verschiebung (engl. lamb shift) der Energiewerte, die erstmals im Lamb-Rutherford-Experiment nachgewiesen wurde. Diese Beobachtung führte zur Entwicklung der Quantenelektrodynamik, einer Quantenfeldtheorie, die mittels Näherungsrechnungen die bislang genaueste Beschreibung des Wasserstoffatoms gibt. Kategorien: Atomphysik | Wasserstoffchemie | Theoretische Chemie |
|||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Wasserstoffatom aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





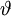 (Breitenwinkel) und
(Breitenwinkel) und 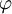 (Längenwinkel) abhängen. Eine vollständige Lösung ergibt sich als das Produkt dreier Einzellösungen.
(Längenwinkel) abhängen. Eine vollständige Lösung ergibt sich als das Produkt dreier Einzellösungen.
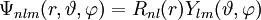
![R_{nl}(r) = \sqrt {{\left(\frac{2}{n a_0}\right)}^3\frac{(n-l-1)!}{2n[(n+l)!]} } e^{- \rho / 2} \rho^{l} L_{n-l-1}^{2l+1}(\rho)](images/math/1/5/9/159e79cb6db8893450d1dced18c8c006.png)
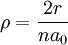 (
(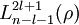 sind die zugeordneten Laguerre-Polynome;
sind die zugeordneten Laguerre-Polynome;
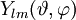 sind die Kugelflächenfunktionen.
sind die Kugelflächenfunktionen.
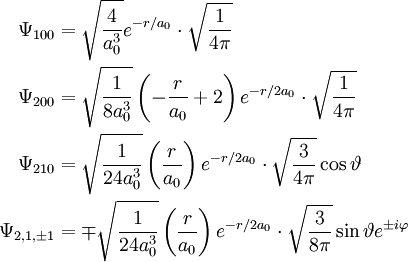
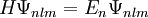
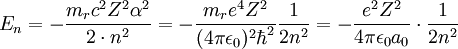 .
.