Neues chemisches Umwandlungsverfahren bei niedrigen Temperaturen entwickelt
Anzeigen
Chemiker verbringen viel Zeit und Energie damit, chemische Reaktionen zu starten oder zu beschleunigen - aber manchmal kann es genauso wichtig sein, sie zu stoppen, bevor sie zu weit gehen.
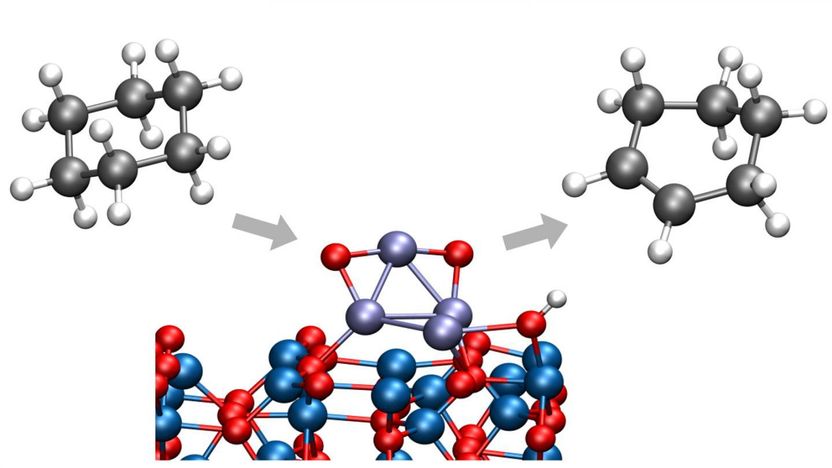
Argonne-Chemiker haben einen Weg gefunden, Cyclohexan in Cyclohexen oder Cyclohexadien umzuwandeln, beides wichtige Chemikalien in einer Vielzahl von industriellen Prozessen. Der neue Prozess findet bei niedrigen Temperaturen statt, so dass keine unerwünschten Nebenprodukte entstehen.
Argonne National Laboratory
In einer aktuellen Studie des Argonne National Laboratory des U.S. Department of Energy (DOE) haben Chemiker einen Weg gefunden, Cyclohexan in Cyclohexen oder Cyclohexadien umzuwandeln, wichtige Chemikalien in einer Vielzahl von industriellen Prozessen. Wichtig ist, dass dieser Prozess bei niedrigen Temperaturen stattfindet, wodurch die Bildung von Kohlendioxid vermieden wird, das durch ein unerwünschtes Brechen von Kohlenstoff-Kohlenstoff-Bindungen entstanden wäre.
"Die Tatsache, dass wir diese Umwandlung bei niedrigeren Temperaturen durchführen können, schützt die Dehydrierungszwischenprodukte Cyclohexen und Cyclohexadien davor, in unerwünschte Produkte weiter umgewandelt werden." -- Stefan Vajda
Cyclohexan ist ein wichtiges Ausgangsmolekül in einer Vielzahl von chemischen Reaktionen, so der Argonne-Chemiker Stefan Vajda, der sich am J. Heyrovský Institut für Physikalische Chemie in Prag arbeitet. Ohne einen geeigneten Katalysator, um die Reaktion einzuleiten, erfordert die Umwandlung von Cyclohexan in nützliche Produkte jedoch typischerweise erhöhte Temperaturen, die durch den hohen Energieaufwand verursacht werden, und der Prozess kann auch unter einer schlechten Selektivität leiden.
In der Studie untersuchten der Vajda- und Argonne-Chemiker Larry Curtiss und sein internationales Team von Mitarbeitern eine Art von Reaktion namens oxidative Dehydrierung, bei der Wasserstoffmoleküle von einem größeren Molekül entfernt werden. Durch das Schneiden einer begrenzten Anzahl von Wasserstoff-Kohlenstoff-Bindungen kann die Reaktion Cyclohexen und Cyclohexadien produzieren, bevor die Verbrennung zu Kohlendioxid stattfindet.
Die Arbeit verbesserte sich auf frühere Studien des Argonne-Teams zur Dehydrierung von Cyclohexan und Cyclohexen durch die Einführung zweier Schlüsselkomponenten: eines Kobaltoxidkatalysators in Sub-Nanometer-Größe auf einem Aluminiumoxidträger und einer kontrollierten Sauerstoffumgebung.
Die Forscher setzten Röntgenstreuungstechniken bei Argonne's Advanced Photon Source (APS), einer DOE Office of Science User Facility, ein, um die Art und Stabilität der Katalysatoren während der katalytischen Prüfung der Cluster in Echtzeit zu überwachen. Sie entdeckten, dass die Cluster eine partielle Dehydrierung des Cyclohexans bei Temperaturen um die 100 Grad Celsius durchführten - weitaus niedriger als zuvor bei dieser Art von Reaktion beobachtet - und die Cluster ihre oxidierte Natur und Stabilität bei Reaktionstemperaturen bis zu 300°C beibehielten.
"Die Tatsache, dass wir diese Umwandlung bei niedrigeren Temperaturen durchführen können, schützt die Dehydrierungszwischenprodukte Cyclohexen und Cyclohexadien vor einer weiteren Umwandlung in unerwünschte Produkte", sagte Vajda.
Vajda und Curtiss stellten fest, dass der hochselektive Katalysator langlebig ist und durch die Reaktion nicht vergiftet oder abgebaut wird. In theoretischen und experimentellen Untersuchungen zur Größe des Katalysators fanden die Forscher heraus, dass Cluster der Größe zwischen 4 und 27 Atomen bei der Durchführung der Reaktion etwa gleich effizient waren. "Es scheint, als ob diese Zusammensetzung gut funktioniert, solange der Katalysator weniger als etwa einen Nanometer groß ist - ein wichtiger Faktor für die mögliche Skalierung dieser Katalysatorklasse durch traditionellere, aber weniger größenselektive Synthesewege." sagte Vajda.
Um die grundlegenden Mechanismen hinter der Aktivität und Selektivität der Kobaltkatalysatoren besser zu verstehen, verwendeten die Forscher Dichtefunktionstheorie-Berechnungen, um die Reaktionswege zu modellieren. "Die ausgezeichnete Leistung der Kobalt-Cluster lässt sich durch theoretische Berechnungen erklären, die hochaktive Kobalt-atome in den Clustern offenbaren und zeigen, dass die oxidierte Natur der Cluster die Niedertemperaturbildung des Produkts verursacht", erklärte Curtiss.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.
































































